Em sua essência, corrosão é a degradação natural de um metal refinado em uma forma quimicamente mais estável, como seu óxido ou sulfeto. Dentro de uma célula eletroquímica, esse processo não é meramente uma reação de superfície, mas um circuito completo onde o metal essencialmente se autodestrói ao criar uma pequena e indesejada bateria em sua própria superfície.
A corrosão é um processo eletroquímico porque envolve os quatro componentes essenciais de uma bateria: um ânodo (onde o metal é perdido), um cátodo, um eletrólito (como água) e um caminho metálico, todos trabalhando juntos para decompor o metal.
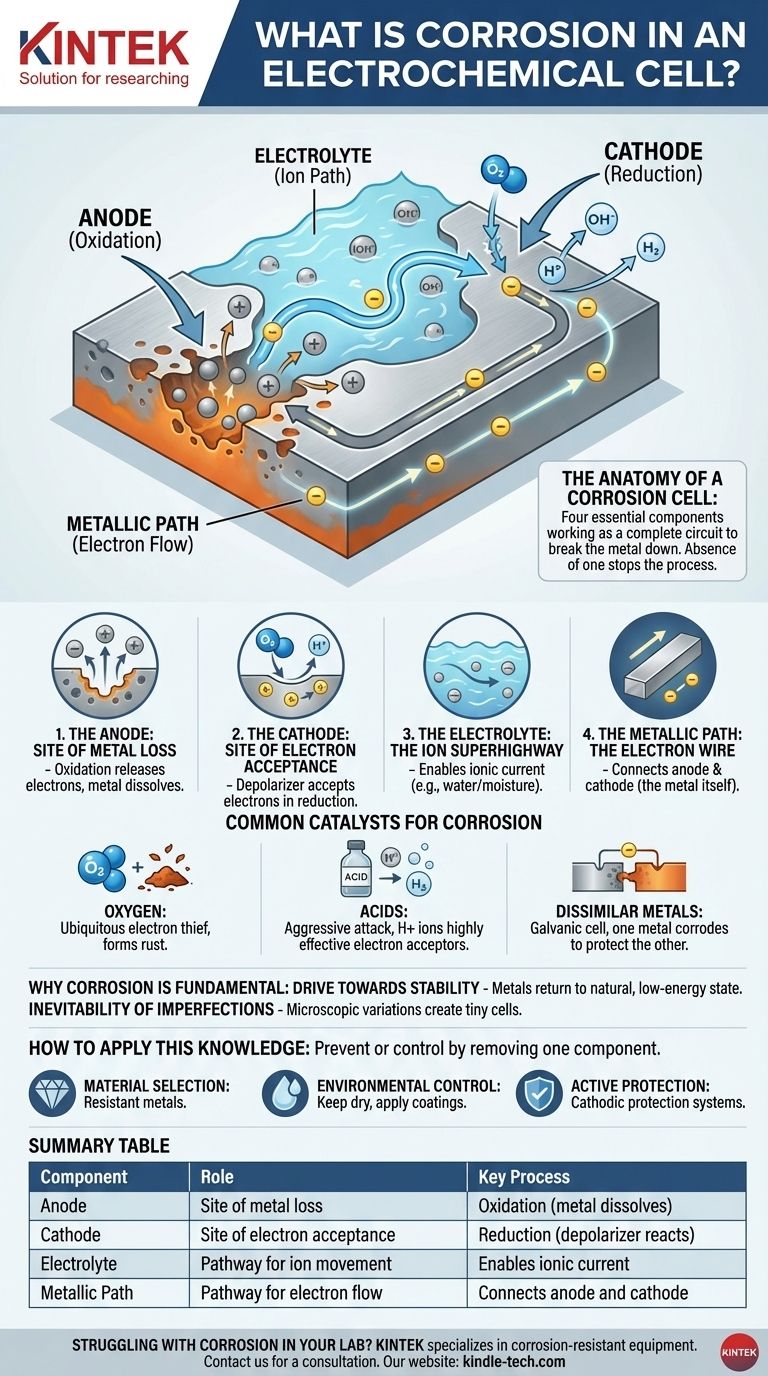
A Anatomia de uma Célula de Corrosão
Entender a corrosão é entender os quatro componentes necessários para que ela funcione. A ausência de qualquer um desses componentes interromperá o processo completamente.
O Ânodo: O Local da Perda de Metal
O local anódico é o ponto específico na superfície do metal onde ocorre a corrosão. Aqui, os átomos de metal sofrem oxidação, perdendo elétrons e se transformando em íons carregados positivamente que se dissolvem na água ou umidade circundante. Este é o ato físico do metal sendo corroído.
O Cátodo: O Local de Aceitação de Elétrons
Os elétrons liberados do ânodo viajam através do metal para um local diferente, o local catódico. Aqui, uma substância no ambiente — conhecida como despolarizador — aceita esses elétrons em uma reação de redução. Este despolarizador é um ingrediente crítico.
O Eletrólito: A Autoestrada de Íons
A água, mesmo em quantidades microscópicas como a umidade, atua como o eletrólito. Ela fornece um meio para os íons metálicos dissolvidos (do ânodo) e outros íons viajarem, completando o circuito elétrico. Sem um eletrólito, os íons não têm como se mover, e o circuito é quebrado.
O Caminho Metálico: O Fio Eletrônico
O corpo do próprio metal serve como o caminho metálico. Ele fornece um caminho condutor para os elétrons viajarem do ânodo para o cátodo. É por isso que os locais anódicos e catódicos podem estar lado a lado ou distantes no mesmo pedaço de metal.
Catalisadores Comuns para a Corrosão
A taxa e a severidade da corrosão são frequentemente ditadas pela disponibilidade e tipo de despolarizador (o aceptor de elétrons) no cátodo.
Oxigênio: O Ladrão de Elétrons Ubíquo
Na maioria dos ambientes comuns, o oxigênio dissolvido é o principal aceptor de elétrons. É por isso que a água e o oxigênio juntos são tão destrutivos para metais como o ferro, levando à formação de ferrugem (óxido de ferro).
Ácidos: Um Ataque Agressivo
Ácidos aceleram drasticamente a corrosão. Os íons de hidrogênio (H+) em uma solução ácida são acepções de elétrons altamente eficazes, criando gás hidrogênio no cátodo. Este processo é tipicamente muito mais rápido e mais agressivo do que a corrosão impulsionada pelo oxigênio.
Metais Dissimilares: A Célula Galvânica
Quando dois metais diferentes estão em contato elétrico dentro de um eletrólito, eles criam uma célula galvânica. O metal menos nobre e mais ativo se tornará o ânodo e corroerá rapidamente, enquanto o metal mais nobre se torna o cátodo e é protegido. É por isso que você vê ânodos de zinco sacrificiais em cascos de barcos para proteger o aço.
Por Que a Corrosão é um Processo Fundamental
A corrosão não é uma falha; é um processo natural e espontâneo impulsionado por leis fundamentais da termodinâmica. Entender essa inevitabilidade é fundamental para gerenciá-la.
A Busca Pela Estabilidade
Metais refinados como alumínio e aço são materiais feitos pelo homem mantidos em um estado de alta energia. A corrosão é simplesmente o processo desse metal retornando ao seu estado natural de baixa energia, semelhante ao minério do qual foi extraído. O metal está liberando sua energia armazenada.
A Inevitabilidade das Imperfeições
Nenhuma superfície metálica é perfeitamente uniforme. Variações microscópicas na composição, estresse da fabricação ou mesmo diferenças na exposição ao oxigênio criam minúsculos locais anódicos e catódicos por toda a superfície. Essas imperfeições são tudo o que é necessário para iniciar milhares de células de corrosão microscópicas.
Como Aplicar Este Conhecimento
Entender que a corrosão é uma célula eletroquímica fornece uma estrutura clara para preveni-la ou controlá-la. A estratégia é sempre remover um dos quatro componentes essenciais.
- Se seu foco principal for a seleção de materiais: Use metais que são naturalmente resistentes à formação de uma célula eletroquímica em seu ambiente de serviço, ou evite conectar metais dissimilares.
- Se seu foco principal for o controle ambiental: Elimine o eletrólito mantendo o metal seco ou aplicando um revestimento à prova d'água (como tinta) para impedir que a umidade atinja a superfície.
- Se seu foco principal for a proteção ativa: Crie intencionalmente uma célula eletroquímica mais poderosa onde seu metal estrutural seja forçado a ser o cátodo. Este é o princípio por trás dos ânodos de sacrifício e dos sistemas de proteção catódica.
Ao ver a corrosão como um circuito simples, você pode diagnosticar sistematicamente sua causa e interromper eficazmente seu caminho destrutivo.

Tabela de Resumo:
| Componente | Função na Célula de Corrosão | Processo Chave |
|---|---|---|
| Ânodo | Local de perda de metal | Oxidação (metal se dissolve) |
| Cátodo | Local de aceitação de elétrons | Redução (despolarizador reage) |
| Eletrólito | Caminho para o movimento de íons | Permite corrente iônica (ex: água) |
| Caminho Metálico | Caminho para o fluxo de elétrons | Conecta ânodo e cátodo (o próprio metal) |
Com problemas de corrosão em seus equipamentos de laboratório?
A corrosão pode comprometer seus experimentos, danificar instrumentos sensíveis e levar a um tempo de inatividade dispendioso. A KINTEK é especializada em equipamentos e consumíveis de laboratório resistentes à corrosão, ajudando você a proteger seus investimentos e garantir a integridade de sua pesquisa.
Nossos especialistas podem ajudar você a selecionar os materiais e soluções corretos para interromper o circuito de corrosão em seu ambiente laboratorial específico.
Entre em contato com a KINTEK hoje para uma consulta e descubra como podemos ajudar você a combater a corrosão e aprimorar o desempenho do seu laboratório.
Guia Visual
Produtos relacionados
- Célula Eletrolítica Eletroquímica para Avaliação de Revestimentos
- Célula Eletrolítica Eletroquímica de Corrosão Plana
- Célula Eletroquímica Eletrolítica de Quartzo para Experimentos Eletroquímicos
- Célula Eletrolítica Eletroquímica Óptica de Dupla Camada Tipo H com Banho de Água
- Célula Eletroquímica de Eletrólise Espectral de Camada Fina
As pessoas também perguntam
- Para que tipo de sistema de eletrodos é projetada a célula eletrolítica de avaliação de revestimento? Desbloqueie a Análise Precisa de Revestimentos
- Como funciona uma célula eletrolítica de três eletrodos? Testes de precisão para aço 8620 em ambientes corrosivos
- Como uma célula eletrolítica eletroquímica de três eletrodos é utilizada para avaliar a resistência à corrosão da liga Zr-Nb?
- Qual a diferença entre célula de corrosão eletrolítica e célula de corrosão eletroquímica? Compreenda a Força Motriz por Trás da Corrosão
- Como uma célula eletrolítica de alta precisão é usada para avaliar a resistência à corrosão de metais? Valide os resultados do DCT com precisão



















