Em termos técnicos, uma célula eletrolítica é um tipo específico de célula eletroquímica. Embora se enquadre nesta categoria ampla, é fundamental entender que "célula eletroquímica" também descreve outro dispositivo — a célula galvânica — que executa a função exatamente oposta.
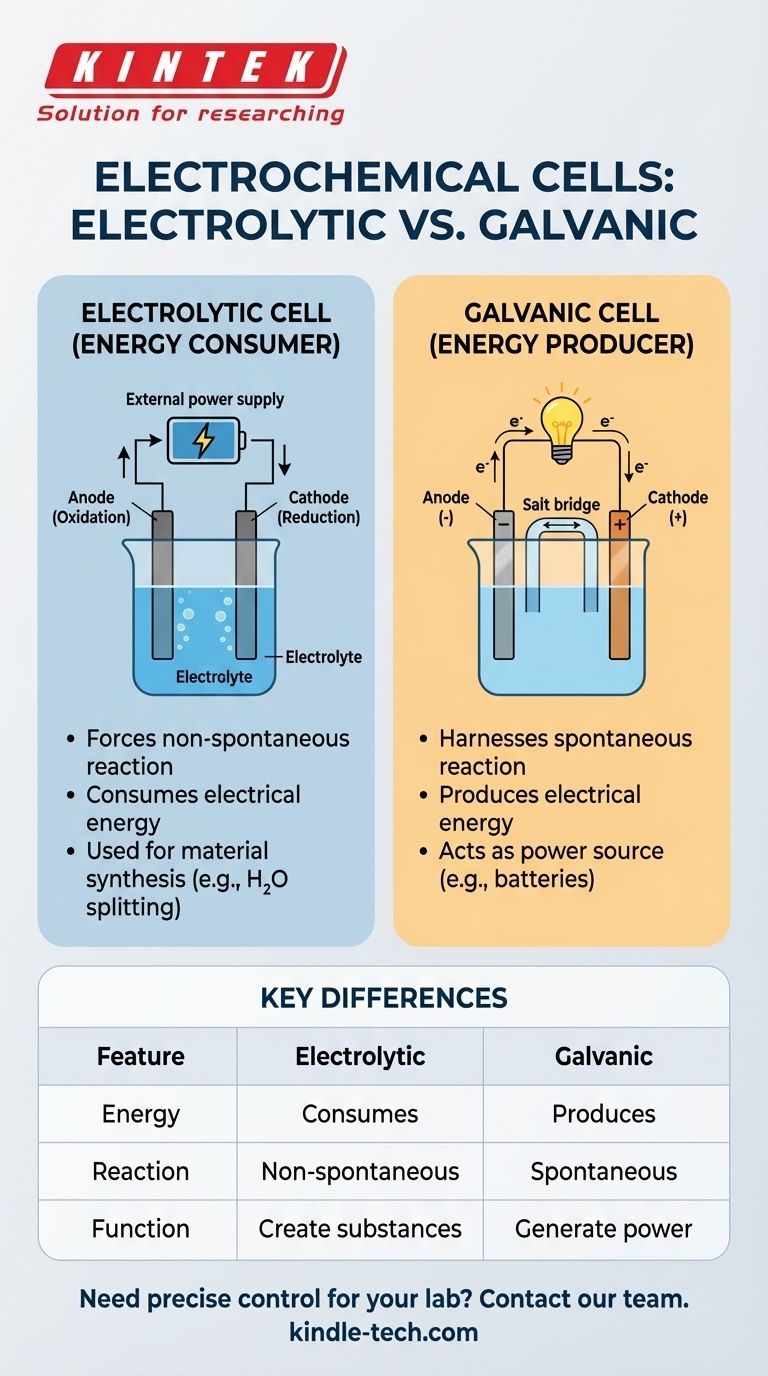
A distinção crucial é esta: Uma célula eletrolítica usa energia elétrica externa para forçar uma reação química que não aconteceria por si só. Ela consome energia. Em contraste, uma célula galvânica (como uma bateria) usa uma reação química espontânea para produzir energia elétrica.

A Função Principal: Forçar uma Reação Química
O que é Eletrólise?
Eletrólise é o processo de usar uma corrente elétrica contínua (CC) para impulsionar uma reação química não espontânea. Em termos simples, é usar eletricidade para fazer uma mudança química acontecer.
O dispositivo onde este processo ocorre é a célula de eletrólise ou célula eletrolítica.
O Papel da Energia Externa
A característica definidora de uma célula eletrolítica é a sua necessidade de uma fonte de energia externa, como uma bateria ou fonte de alimentação. Esta voltagem externa supera a barreira de energia natural da reação, forçando os produtos químicos a reagir.
Componentes Chave
Uma célula eletrolítica consiste em dois eletrodos, um ânodo e um cátodo, submersos em uma solução líquida chamada eletrólito. A fonte de energia externa puxa elétrons do ânodo (oxidação) e os empurra para o cátodo (redução), impulsionando a mudança química desejada.
Eletrolítica vs. Galvânica: O Guarda-chuva da "Célula Eletroquímica"
O termo célula eletroquímica é uma categoria pai para qualquer dispositivo que converte entre energia química e elétrica. Compreender os dois tipos principais é essencial para a clareza.
Células Eletrolíticas: Consumidoras de Energia
Essas células consomem energia elétrica para produzir uma mudança química. Seu principal objetivo é criar substâncias ou alterar materiais através de uma reação forçada.
Um exemplo comum é o uso de uma célula eletrolítica para dividir a água (H₂O) em hidrogênio e gás oxigênio, um processo que requer uma entrada significativa de energia.
Células Galvânicas (Voltaicas): Produtoras de Energia
Essas células fazem o oposto. Elas aproveitam uma reação química espontânea para gerar uma corrente elétrica. Este é o princípio fundamental por trás de todas as baterias comuns.
Ao usar uma bateria, você está usando uma célula galvânica para converter energia química armazenada em energia elétrica utilizável.
Por que a Distinção Importa
Chamar uma célula eletrolítica de "célula eletroquímica" é tecnicamente correto, mas impreciso. É como chamar um quadrado de "retângulo". Embora verdadeiro, omite as propriedades específicas que o definem. A principal diferença é sempre a direção da conversão de energia.
Aplicações Comuns e Compromissos
Onde a Eletrólise é Usada
A capacidade de forçar reações químicas tem um imenso valor industrial. Células eletrolíticas são essenciais para produzir hidrogênio puro para combustível, refinar metais como alumínio e cobre a partir de minério, e eletrodepositar objetos com uma fina camada de metal como cromo ou ouro.
O Principal Compromisso: Custo de Energia
A principal limitação da eletrólise é o seu alto consumo de energia. Como você está forçando uma reação não espontânea, o processo sempre requer mais energia do que a energia química que você armazena ou o valor do produto que você cria. Este custo de energia é a consideração econômica e ambiental central para qualquer processo de eletrólise industrial.
Como Identificar a Célula Certa para o Seu Objetivo
- Se o seu foco principal é armazenar energia ou criar materiais (como combustível de hidrogênio ou alumínio puro): Você está lidando com uma célula eletrolítica, que consome eletricidade para impulsionar uma reação química.
- Se o seu foco principal é gerar energia a partir de uma fonte química (como uma bateria): Você está lidando com uma célula galvânica (ou voltaica), que produz eletricidade a partir de uma reação espontânea.
- Se o seu foco principal é o campo científico geral que abrange ambos os processos: Você deve usar o termo guarda-chuva célula eletroquímica.
Em última análise, entender a direção do fluxo de energia — se está sendo consumida ou produzida — é a chave para distinguir entre esses dispositivos fundamentais.
Tabela Resumo:
| Característica | Célula Eletrolítica | Célula Galvânica |
|---|---|---|
| Conversão de Energia | Consome energia elétrica | Produz energia elétrica |
| Tipo de Reação | Não espontânea (forçada) | Espontânea |
| Função Principal | Criar substâncias (ex: H₂, metais refinados) | Gerar energia (ex: baterias) |
| Fonte de Energia | Requer fonte externa (ex: bateria, fonte de alimentação) | É a própria fonte de energia |
Precisa de controle preciso sobre reações químicas em seu laboratório?
Seja sua pesquisa envolvendo síntese de materiais, eletrodeposição ou armazenamento de energia, ter o equipamento certo é fundamental. A KINTEK é especializada em equipamentos e consumíveis de laboratório de alta qualidade, incluindo células eletroquímicas e fontes de alimentação, projetados para confiabilidade e precisão.
Deixe nossos especialistas ajudá-lo a selecionar a configuração perfeita para sua aplicação específica. Entre em contato com nossa equipe hoje para discutir suas necessidades de laboratório e descobrir como a KINTEK pode apoiar seus objetivos de pesquisa.
Guia Visual
Produtos relacionados
- Célula Eletroquímica Eletrolítica com Cinco Portas
- Célula Eletrolítica de Banho de Água de Cinco Portas de Camada Dupla
- Célula Eletroquímica Eletrolítica de Banho de Água de Dupla Camada
- Células Eletrolíticas PEM Personalizáveis para Diversas Aplicações de Pesquisa
- Célula Eletrolítica Tipo H Tripla Eletroquímica
As pessoas também perguntam
- Que precauções devem ser tomadas em relação à temperatura ao usar uma célula eletrolítica totalmente de PTFE? Garanta Experimentos Seguros e Precisos
- Quais são os riscos do controle inadequado de tensão em uma célula de eletrólise? Evite Danos Caros e Ineficiência
- Quais são as vantagens de usar aço inoxidável resistente à corrosão para uma célula de reação? Garanta a integridade dos dados in-situ
- Como a reação eletroquímica pode ser controlada ao usar esta célula eletrolítica? Tensão, Corrente e Eletrólito Mestres
- Quais são os requisitos para uma célula eletrolítica com janela de quartzo? Garanta testes de desempenho PEC precisos
- Como uma estação de trabalho eletroquímica auxilia na avaliação da resistência à corrosão? Quantificação do Desempenho do Aço Remelhado a Laser
- Quais são os materiais e as principais características da célula eletrolítica Raman in-situ? Otimize sua pesquisa espectroscópica
- Célula eletroquímica também é conhecida como célula eletrolítica? Entenda a Diferença Chave na Conversão de Energia



















