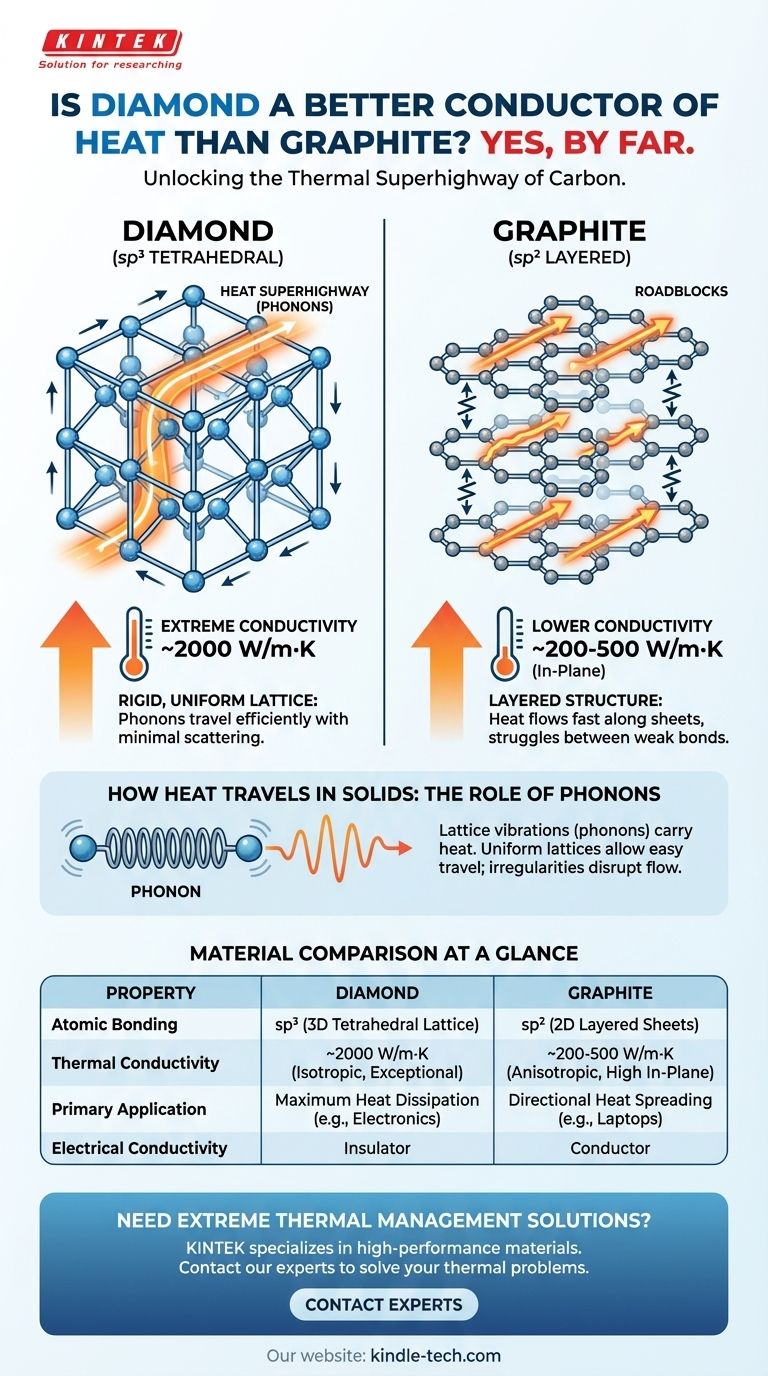
Sim, o diamante é um condutor térmico vastamente superior ao grafite. Embora ambos sejam formas puras de carbono, a estrutura atômica única do diamante permite-lhe transferir calor com extrema eficiência, tornando-o um dos melhores condutores térmicos de qualquer material conhecido à temperatura ambiente. A sua condutividade térmica pode ser mais de cinco vezes superior à do cobre e muitas vezes superior à do grafite.
A razão principal para esta diferença reside não na sua composição química, mas na sua arquitetura atômica. A rede rígida e tridimensional do diamante é uma "super-autoestrada" altamente eficiente para a energia térmica, enquanto a estrutura em camadas do grafite cria obstáculos significativos que impedem o fluxo térmico.
Como o Calor Viaja em Sólidos: O Papel dos Fônons
O que é um Fônon?
Num sólido eletricamente isolante, o calor não é transportado por elétrons, mas por vibrações da rede. Pense nos átomos do cristal como estando conectados por molas. Uma vibração numa extremidade cria uma onda que viaja por toda a estrutura.
Estas ondas quantizadas de vibração atômica são chamadas de fônons. A eficiência da condução de calor depende da facilidade com que estes fônons podem viajar através do material sem serem espalhados ou perturbados.
A Importância de uma Rede Rígida e Uniforme
Um material perfeito para a condução de calor possui ligações atômicas fortes e rígidas e uma estrutura altamente ordenada e uniforme. Isso permite que a energia vibracional (fônons) se propague de forma limpa com mínima resistência.
Qualquer irregularidade, impureza ou fraqueza na rede atua como um ponto de espalhamento, perturbando o fluxo de fônons e reduzindo a condutividade térmica.
A Vantagem do Diamante: Uma Rede Perfeita para a Transferência de Calor
A Estrutura Tetraédrica com Ligações sp³
Cada átomo de carbono num diamante está ligado a outros quatro átomos de carbono numa disposição tetraédrica. Esta ligação sp³ repete-se em todas as três dimensões, criando uma rede cúbica incrivelmente forte, rígida e contínua.
Esta estrutura é o que torna o diamante o material natural mais duro conhecido. Não há pontos fracos ou planos dentro do cristal.
Por que Esta Estrutura se Destaca no Transporte de Fônons
A rede rígida e perfeitamente uniforme do diamante é um meio ideal para o transporte de fônons. As fortes ligações covalentes permitem que a energia vibracional viaje a velocidades muito altas com muito pouco espalhamento.
Isso torna o diamante um condutor térmico excepcional, com uma condutividade em torno de 2000 W/m·K. É por isso que o diamante é usado como dissipador de calor para eletrônicos de alta potência onde a dissipação de calor é crítica.
A Limitação do Grafite: Uma História de Duas Direções
A Estrutura em Camadas com Ligações sp²
No grafite, cada átomo de carbono está ligado a apenas outros três numa folha hexagonal plana. Esta ligação sp² é muito forte, mas apenas dentro do plano bidimensional da folha.
Estas folhas são empilhadas umas sobre as outras e são mantidas unidas por forças muito mais fracas (forças de van der Waals). Esta estrutura em camadas é o que permite que o grafite seja quebradiço e atue como um bom lubrificante, pois as camadas podem deslizar facilmente umas sobre as outras.
Condutividade Anisotrópica: Rápida ao Longo das Folhas, Lenta Entre Elas
Esta estrutura em camadas torna a condutividade térmica do grafite anisotrópica, o que significa que é diferente em diferentes direções.
O calor viaja de forma muito eficiente ao longo das folhas hexagonais, mas tem dificuldade em saltar de uma folha para a seguinte através das ligações fracas. A fraca conexão interlaminar atua como um grande gargalo para o transporte de fônons.
Como resultado, a condutividade térmica geral do grafite é significativamente menor que a do diamante, variando tipicamente de 200-500 W/m·K dentro dos planos e muito menos entre eles.
Compreendendo as Trocas: Estabilidade vs. Desempenho
O Paradoxo da Estabilidade Termodinâmica
As referências observam corretamente que, à temperatura e pressão padrão, o grafite é a forma mais termodinamicamente estável de carbono. O diamante é tecnicamente metaestável.
No entanto, esta estabilidade termodinâmica não tem influência no seu desempenho térmico. As propriedades de um material são ditadas pela sua estrutura, não pela sua estabilidade relativa.
A Barreira de Energia de Ativação
O diamante não se transforma espontaneamente no grafite mais estável porque uma barreira de energia de ativação muito grande separa as duas formas.
Uma imensa quantidade de energia é necessária para quebrar as ligações sp³ rígidas do diamante para permitir que se reformem na estrutura sp² do grafite. Esta alta barreira é o que torna os diamantes efetivamente permanentes em condições normais.
Fazendo a Escolha Certa para o Seu Objetivo
Ao selecionar um alótropo de carbono, a aplicação dita a escolha.
- Se o seu foco principal é a dissipação térmica máxima: O diamante é a escolha inigualável, usado para dissipadores de calor de alto desempenho, ferramentas de corte e substratos eletrônicos especializados.
- Se o seu foco principal é a propagação de calor direcional e econômica: As folhas de grafite são excelentes para mover o calor lateralmente para longe de uma fonte, uma estratégia comum em eletrônicos de consumo como telefones e laptops.
- Se o seu foco principal é a condutividade elétrica ou lubrificação: O grafite é a opção superior, pois seus elétrons deslocalizados permitem que ele conduza eletricidade e suas fracas ligações interlaminares permitem que ele atue como um lubrificante seco.
Em última análise, compreender a ligação direta entre a estrutura atômica de um material e suas propriedades físicas é a chave para resolver qualquer desafio de engenharia.

Tabela Resumo:
| Propriedade | Diamante | Grafite |
|---|---|---|
| Ligação Atômica | sp³ (rede tetraédrica 3D) | sp² (folhas em camadas 2D) |
| Condutividade Térmica | ~2000 W/m·K (excepcional, isotrópica) | 200-500 W/m·K (anisotrópica, alta no plano) |
| Aplicação Primária | Dissipação máxima de calor (ex: eletrônicos) | Propagação direcional de calor (ex: laptops) |
| Condutividade Elétrica | Isolante | Condutor |
Precisa de uma solução de material para gerenciamento térmico extremo?
A KINTEK é especializada em equipamentos e materiais de laboratório de alto desempenho, incluindo soluções térmicas avançadas. Quer o seu projeto exija a dissipação de calor inigualável do diamante ou as propriedades direcionais e econômicas do grafite, a nossa experiência pode ajudá-lo a selecionar o material perfeito para a sua aplicação específica.
Entre em contato com nossos especialistas hoje para discutir como podemos aprimorar as capacidades do seu laboratório e resolver seus problemas térmicos mais desafiadores.
Guia Visual
Produtos relacionados
- Diamante CVD para Aplicações de Gerenciamento Térmico
- Domos de Diamante CVD para Aplicações Industriais e Científicas
- Dissipador de Calor Corrugado Plano de Cerâmica de Carboneto de Silício (SIC) para Cerâmica Fina Avançada de Engenharia
- Blankos de Ferramentas de Corte de Diamante CVD para Usinagem de Precisão
- Sistema de Reator de Máquina MPCVD com Ressonador Cilíndrico para Deposição Química de Vapor por Plasma de Micro-ondas e Crescimento de Diamante de Laboratório
As pessoas também perguntam
- Qual é o valor futuro do diamante cultivado em laboratório? Compreendendo o seu valor financeiro depreciativo
- Qual é a principal diferença entre um diamante CVD e um diamante natural? Origem, Pureza e Valor Explicados
- Qual é a diferença entre um diamante CVD e um diamante original? Escolha o diamante certo para as suas necessidades
- O que é um diamante CVD? O Guia Definitivo sobre Diamantes Cultivados em Laboratório e Seus Usos
- Qual é o processo dos diamantes criados em laboratório? Um Guia Claro para os Métodos HPHT e CVD



















