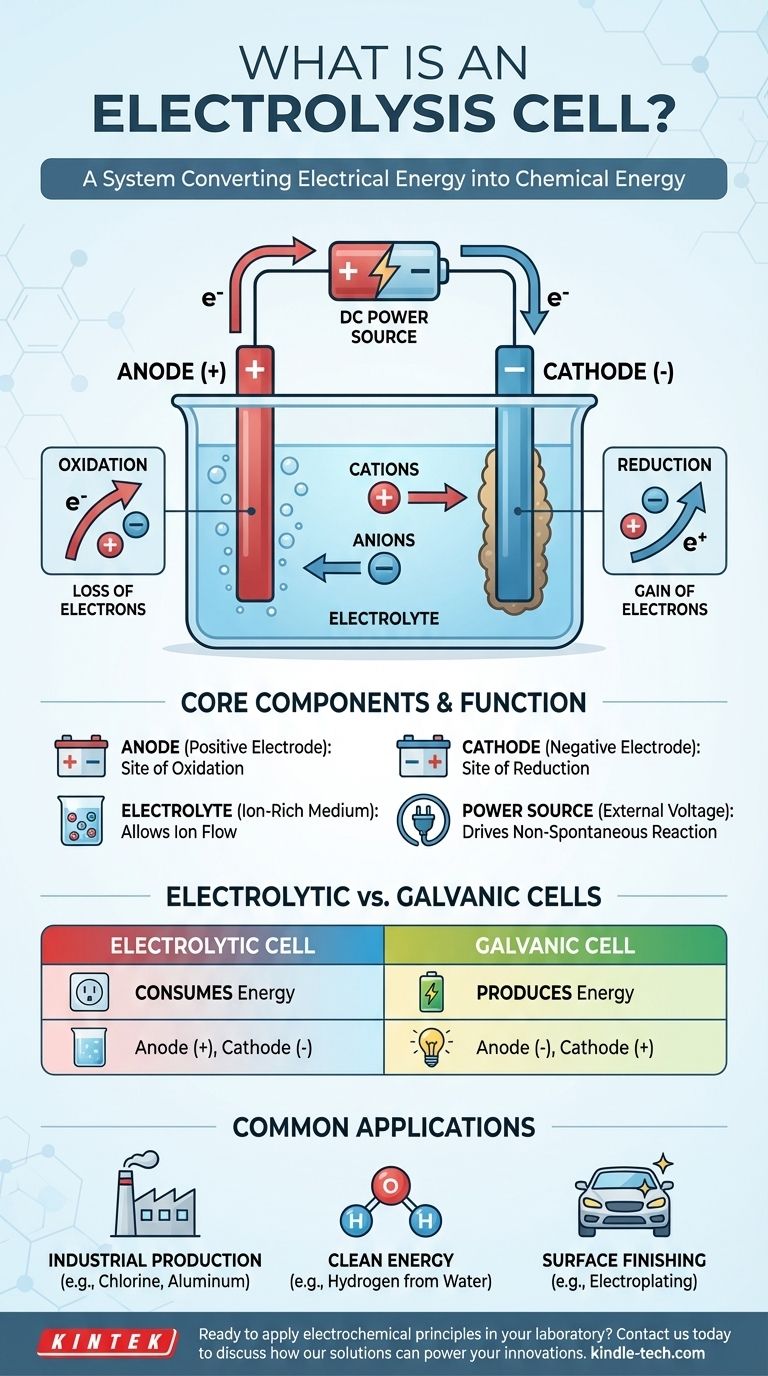
Fundamentalmente, uma célula eletrolítica é um dispositivo que utiliza energia elétrica para impulsionar uma reação química que, de outra forma, não ocorreria espontaneamente. Ela efetivamente reverte o processo de uma bateria, consumindo energia para decompor compostos ou sintetizar novos. Isso é alcançado passando uma corrente elétrica contínua através de uma substância chamada eletrólito, forçando mudanças químicas em dois eletrodos.
Uma célula eletrolítica é melhor entendida como um sistema para converter energia elétrica em energia química. Ela funciona aplicando uma tensão externa para superar o estado natural de um sistema químico, forçando os íons a reagir e criar novas substâncias.

Como Funciona uma Célula Eletrolítica
Para entender o conceito, é essencial compreender os três componentes centrais e como eles interagem quando a eletricidade é introduzida. O processo é um fluxo controlado e direcionado de carga que resulta em transformação química.
Os Três Componentes Essenciais
Uma célula eletrolítica é composta por três partes principais:
- Um Ânodo: O eletrodo conectado ao terminal positivo da fonte de alimentação.
- Um Cátodo: O eletrodo conectado ao terminal negativo da fonte de alimentação.
- Um Eletrólito: Uma substância que contém íons livres, como um sal fundido ou um composto iônico dissolvido em um solvente como a água.
O Papel da Tensão Externa
Ao contrário de uma bateria (célula galvânica) que produz tensão espontaneamente, uma célula eletrolítica requer uma fonte de alimentação externa. Essa tensão aplicada estabelece um forte campo elétrico e dita a polaridade dos eletrodos, tornando o ânodo positivo e o cátodo negativo.
O Fluxo de Íons e Elétrons
A tensão aplicada força os íons dentro do eletrólito a migrar. Íons carregados positivamente (cátions) são atraídos para o cátodo negativo, enquanto íons carregados negativamente (ânions) são atraídos para o ânodo positivo. Essa migração prepara o cenário para as reações químicas.
Oxidação e Redução: A Química Central
A mudança química real ocorre na superfície dos eletrodos. Essas reações são conhecidas como reações "redox", abreviação de redução e oxidação.
O Ânodo: Local da Oxidação
O ânodo é definido como o local da oxidação. Aqui, os ânions que migraram para o eletrodo positivo cedem seus elétrons em excesso. Essa perda de elétrons é a definição de oxidação.
O Cátodo: Local da Redução
O cátodo é definido como o local da redução. Os cátions atraídos para este eletrodo negativo aceitam elétrons do circuito. Esse ganho de elétrons é a definição de redução, resultando frequentemente na deposição de um elemento neutro (como um metal) sobre o cátodo.
Compreendendo a Distinção Chave: Células Eletrolíticas vs. Galvânicas
Um ponto comum de confusão é a diferença entre uma célula eletrolítica e uma célula galvânica (como uma bateria comum). Compreender suas funções opostas é fundamental.
Consumo vs. Produção de Energia
A diferença mais importante é o fluxo de energia. Uma célula eletrolítica consome energia para impulsionar uma reação não espontânea. Uma célula galvânica libera energia de uma reação espontânea.
Polaridade dos Eletrodos
Essa diferença de função leva a uma convenção de sinal oposta para os eletrodos.
- Em uma célula eletrolítica, o ânodo é positivo e o cátodo é negativo.
- Em uma célula galvânica, o ânodo é negativo e o cátodo é positivo.
Lembre-se que em ambos os tipos de célula, a oxidação *sempre* ocorre no ânodo e a redução *sempre* ocorre no cátodo. O que muda é a polaridade.
Aplicações Comuns da Eletrólise
A capacidade de forçar a mudança química com eletricidade torna as células eletrolíticas incrivelmente úteis em muitas indústrias.
Produção Industrial
A eletrólise é a pedra angular da indústria cloro-álcali, que produz gás cloro e hidróxido de sódio. É também essencial para a produção de metais puros como alumínio e cobre a partir de seus minérios.
Energia Limpa
Uma das aplicações mais promissoras é a eletrólise da água. Ao passar uma corrente pela água, ela pode ser decomposta em seus elementos constituintes: hidrogênio e oxigênio. O hidrogênio resultante pode ser usado como combustível limpo.
Acabamento de Superfície
A eletrodeposição (galvanoplastia) é um processo comum onde uma célula eletrolítica é usada para depositar uma fina camada de um metal (como ouro ou cromo) na superfície de outro objeto, que atua como cátodo.
Fazendo a Escolha Certa para o Seu Objetivo
Compreender o princípio da eletrólise permite aplicá-lo a objetivos específicos.
- Se o seu foco principal é a produção de material (ex: hidrogênio): Reconheça que a célula é uma ferramenta para quebrar compostos estáveis e de baixa energia (como a água) em produtos de alta energia e valor (como gás H₂).
- Se o seu foco principal é o revestimento de superfície (eletrodeposição): Entenda que seu objeto alvo deve ser o cátodo, pois é onde os íons metálicos positivos serão reduzidos e depositados como uma camada sólida.
- Se o seu foco principal é a eletroquímica fundamental: A conclusão mais crucial é que uma célula eletrolítica usa energia externa para reverter um processo químico natural, tornando-a um motor poderoso para a síntese.
Ao dominar esses princípios, você pode alavancar a eletrólise como uma ferramenta poderosa e precisa para a transformação química.
Tabela Resumo:
| Componente | Função | Característica Principal |
|---|---|---|
| Ânodo | Local da Oxidação (perda de elétrons) | Conectado ao terminal positivo da fonte de alimentação |
| Cátodo | Local da Redução (ganho de elétrons) | Conectado ao terminal negativo da fonte de alimentação |
| Eletrólito | Fornece meio para o fluxo de íons | Um sal fundido ou solução iônica contendo íons livres |
| Fonte de Alimentação | Impulsiona a reação não espontânea | Fornece a tensão externa necessária para a eletrólise |
Pronto para aplicar princípios eletroquímicos no seu laboratório?
Quer seu projeto envolva síntese de materiais, eletrodeposição ou desenvolvimento de soluções de energia limpa, ter o equipamento certo é fundamental. A KINTEK é especializada em fornecer equipamentos e consumíveis de laboratório de alta qualidade para apoiar sua pesquisa e desenvolvimento eletroquímico.
Entre em contato conosco hoje para discutir como nossas soluções podem impulsionar suas inovações e fornecer a precisão e confiabilidade que seu laboratório necessita.
Guia Visual
Produtos relacionados
- Célula Eletroquímica Eletrolítica com Cinco Portas
- Célula Eletrolítica Tipo H Tripla Eletroquímica
- Célula Eletrolítica Eletroquímica Óptica de Dupla Camada Tipo H com Banho de Água
- Célula Eletroquímica Eletrolítica de Quartzo para Experimentos Eletroquímicos
- Célula Eletrolítica Eletroquímica para Avaliação de Revestimentos
As pessoas também perguntam
- Como o corpo de uma célula eletrolítica deve ser mantido para longevidade? Estenda a vida útil do seu equipamento
- De que material é feita a célula eletrolítica de banho-maria de cinco portas? Vidro Borossilicato Alto e PTFE Explicados
- Como evitar a contaminação durante os experimentos com a célula eletrolítica de banho de água de cinco portas? Domine o Protocolo dos 3 Pilares
- Que precaução geral deve ser tomada ao manusear a célula eletrolítica? Garanta Resultados de Laboratório Seguros e Precisos
- Quais são os procedimentos corretos de armazenamento para a célula eletrolítica multifuncional? Proteja seu Investimento e Garanta a Precisão dos Dados



















