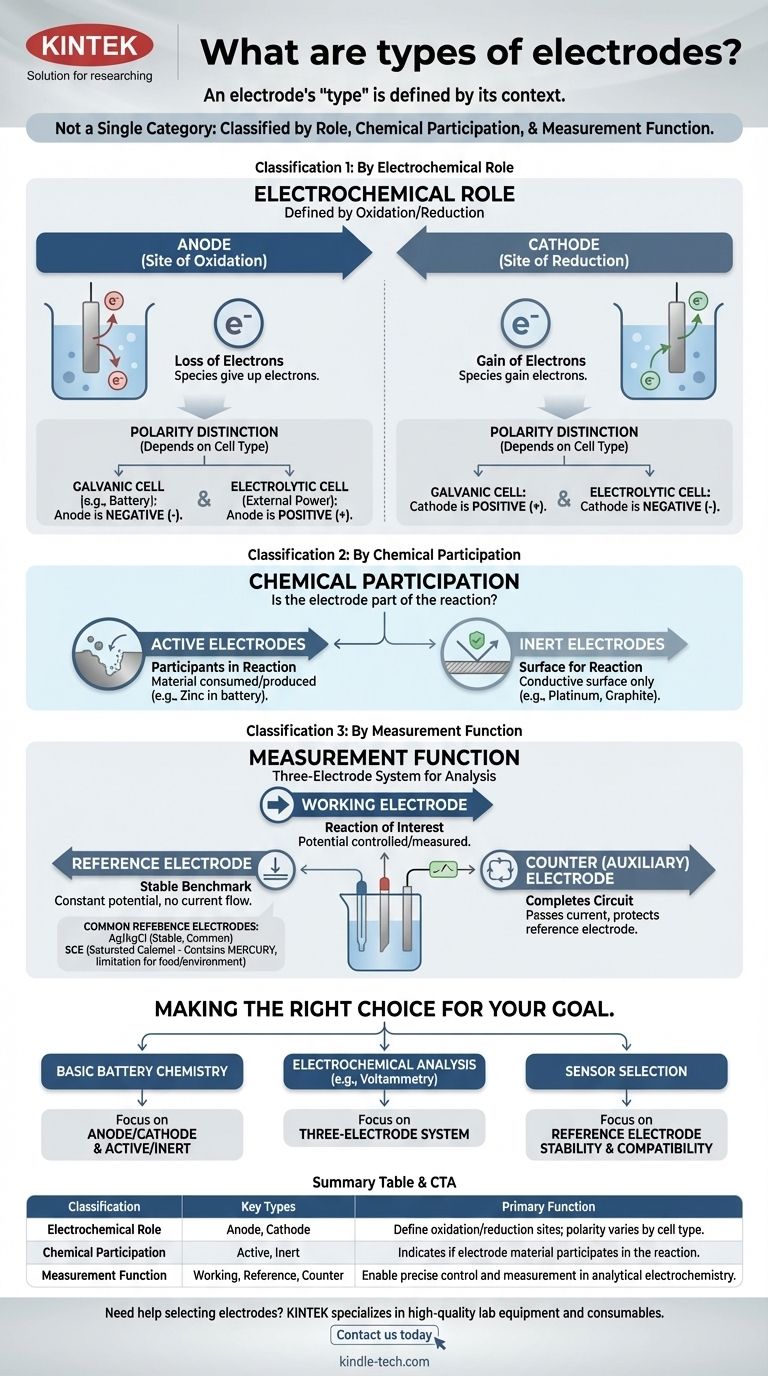
O termo "eletrodo" não é uma categoria única. Em vez disso, os eletrodos são classificados de várias maneiras distintas com base em seu papel em uma reação, sua participação química e sua função dentro de um sistema de medição. Compreender esses diferentes sistemas de classificação é a chave para entender seu propósito em qualquer célula eletroquímica.
A percepção mais crítica é que o "tipo" de um eletrodo é definido por seu contexto. A mesma peça de metal pode ser um ânodo ou um cátodo, ativo ou inerte, dependendo inteiramente do sistema eletroquímico em que você a coloca.
Classificação 1: Por Papel Eletroquímico
A classificação mais fundamental define um eletrodo por seu papel nas duas metades de uma reação eletroquímica: oxidação e redução.
O Ânodo: O Local da Oxidação
O ânodo é, por definição, o eletrodo onde ocorre a oxidação — a perda de elétrons. As espécies no ânodo cedem seus elétrons ao eletrodo.
O Cátodo: O Local da Redução
O cátodo é o eletrodo onde ocorre a redução — o ganho de elétrons. O cátodo cede seus elétrons às espécies na solução.
A Distinção Crítica: Polaridade Ânodo/Cátodo
Um ponto comum de confusão é a carga (+ ou -) do ânodo e do cátodo. Essa polaridade depende do tipo de célula:
- Em uma célula galvânica (como uma bateria), a reação espontânea gera energia. O ânodo é o terminal negativo e o cátodo é o terminal positivo.
- Em uma célula eletrolítica, uma fonte de energia externa impulsiona uma reação não espontânea. O ânodo é o terminal positivo e o cátodo é o terminal negativo.
Classificação 2: Por Participação Química
Essa classificação descreve se o próprio material do eletrodo faz parte da reação química.
Eletrodos Ativos: Participantes na Reação
Um eletrodo ativo é feito de um material que é consumido ou produzido durante a reação da célula. Por exemplo, em uma bateria de zinco-cobre, o ânodo de zinco se dissolve, participando ativamente da meia-reação de oxidação.
Eletrodos Inertes: Uma Superfície para Reação
Um eletrodo inerte não participa da reação química. Ele serve apenas como uma superfície condutora onde a oxidação ou redução pode ocorrer. Platina e carbono (grafite) são eletrodos inertes comuns usados para facilitar reações envolvendo gases ou íons dissolvidos.
Classificação 3: Por Função de Medição
Na eletroquímica analítica, um sistema de três eletrodos é frequentemente usado para medições precisas. Isso dá origem a uma classificação funcional.
O Eletrodo de Trabalho
Este é o eletrodo onde a reação de interesse está ocorrendo. Seu potencial é a variável principal sendo controlada ou medida.
O Eletrodo de Referência: O Padrão Estável
Um eletrodo de referência fornece um potencial estável e constante contra o qual o potencial do eletrodo de trabalho é medido. Seu próprio potencial não muda, independentemente da corrente que flui ou da composição da solução em massa.
O Eletrodo Auxiliar (ou de Contracorrente)
O único propósito deste eletrodo é completar o circuito elétrico. Ele passa toda a corrente necessária pelo eletrodo de trabalho, garantindo que uma corrente insignificante flua através do eletrodo de referência sensível, protegendo assim sua estabilidade.
Compreendendo as Compensações: Eletrodos de Referência Comuns
A escolha do eletrodo de referência é crítica para medições precisas e depende do ambiente químico.
Ag/AgCl: O Cavalo de Batalha Comum
O eletrodo de Prata/Cloreto de Prata (Ag/AgCl) é o eletrodo de referência mais comum. É estável, barato e geralmente confiável, tornando-o uma escolha padrão para muitas soluções aquosas.
Eletrodo de Calomelano Saturado (ECS): A Alternativa Clássica
O Eletrodo de Calomelano Saturado (ECS) é um padrão mais antigo e altamente estável. É frequentemente usado em situações onde a solução da amostra é incompatível com íons de prata ou cloreto, que poderiam interferir com o eletrodo Ag/AgCl.
O Problema do Mercúrio: Uma Limitação Chave
A principal desvantagem do ECS é que ele contém mercúrio. Isso o torna inadequado para aplicações envolvendo alimentos, bebidas ou testes ambientais onde a contaminação por mercúrio é uma preocupação significativa.
Fazendo a Escolha Certa para o Seu Objetivo
Sua aplicação determina qual classificação é mais importante.
- Se o seu foco principal é entender a química básica da bateria: Domine os conceitos de ânodo/cátodo e eletrodos ativos/inertes.
- Se o seu foco principal é realizar análises eletroquímicas (como voltametria): O sistema de três eletrodos (trabalho, referência, auxiliar) é a estrutura essencial.
- Se o seu foco principal é selecionar um sensor para um ambiente específico: Sua principal preocupação será a compatibilidade química e a estabilidade do seu eletrodo de referência, como escolher entre Ag/AgCl e uma alternativa.
Compreender essas classificações sobrepostas permite que você controle e interprete o comportamento de qualquer sistema eletroquímico.

Tabela Resumo:
| Classificação | Tipos Chave | Função Primária |
|---|---|---|
| Papel Eletroquímico | Ânodo, Cátodo | Definem locais de oxidação/redução; a polaridade varia por tipo de célula (galvânica/eletrolítica) |
| Participação Química | Ativo, Inerte | Indica se o material do eletrodo participa da reação ou atua apenas como superfície |
| Função de Medição | Trabalho, Referência, Auxiliar | Permitem controle e medição precisos em eletroquímica analítica |
Precisa de ajuda para selecionar os eletrodos certos para as aplicações eletroquímicas do seu laboratório? Na KINTEK, somos especializados em fornecer equipamentos e consumíveis de laboratório de alta qualidade, adaptados às suas necessidades de pesquisa. Seja você trabalhando no desenvolvimento de baterias, design de sensores ou medições analíticas, nossa experiência garante que você obtenha os eletrodos ideais para precisão e desempenho. Entre em contato conosco hoje para discutir suas necessidades e aprimorar seus fluxos de trabalho eletroquímicos!
Guia Visual
Produtos relacionados
- Eletrodo de Disco de Platina Rotativo para Aplicações Eletroquímicas
- Eletrodo de Disco de Ouro
- Eletrodo de Referência de Sulfato de Cobre para Uso em Laboratório
- Eletrodo Auxiliar de Platina para Uso Laboratorial
- Eletrodo de Chapa de Platina para Aplicações Laboratoriais e Industriais
As pessoas também perguntam
- Qual é o papel de um eletrodo de referência de membrana de zircônia no monitoramento de ligas FeCrAl? Prevenir SCC a 288°C
- Qual via de reação e mecanismo estão associados ao uso de eletrodos de grafite na conversão de biomassa?
- Quais são as vantagens e desvantagens do eletrodo de referência de sulfato de cobre tipo núcleo cerâmico?
- Qual é a função de um contra-eletrodo de malha de platina? Otimize os testes de corrosão de revestimento de Nitinol com a KINTEK
- Como uma haste condutora de aço inoxidável suporta operações catódicas? Dicas Essenciais para o Sucesso da Eletrólise FFC
- Quais procedimentos pós-tratamento devem ser seguidos após usar um eletrodo de placa de ouro? Garanta precisão e desempenho a longo prazo
- Qual é o papel de um eletrodo de platina como contra-eletrodo? Garanta a integridade dos dados em pesquisas de corrosão de revestimentos
- O que é comumente usado como material de ânodo? Escolhendo entre Eletrodos Inertes e Ativos



















