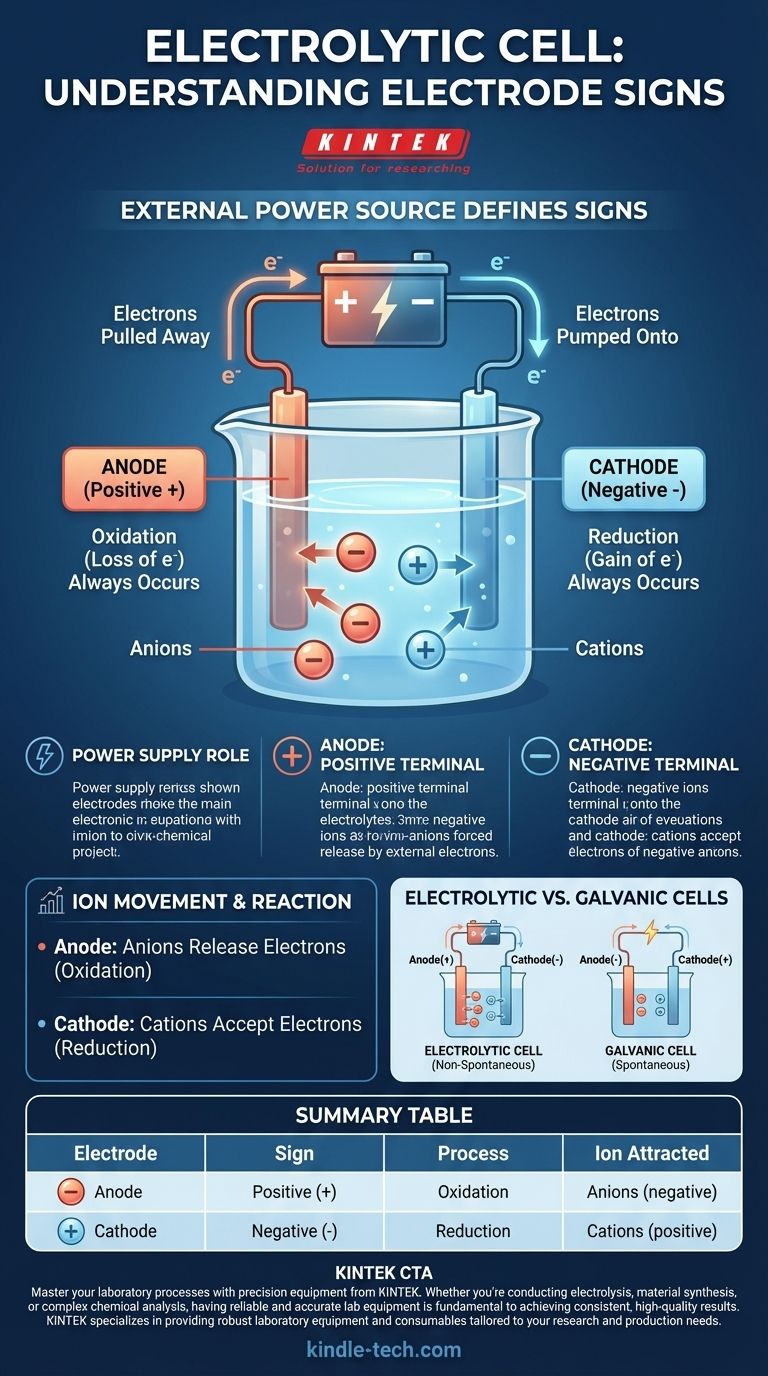
Em uma célula eletrolítica, a convenção de sinais é definida pela fonte de energia externa. O ânodo recebe o sinal positivo (+), e o cátodo recebe o sinal negativo (-). Isso ocorre porque uma tensão externa é aplicada para forçar uma reação química que não ocorreria espontaneamente.
A chave para entender uma célula eletrolítica é reconhecer que ela não é um sistema autossuficiente. Os sinais de seus eletrodos são ditados inteiramente pela fonte de alimentação externa à qual está conectada, forçando a ocorrência de uma alteração química não espontânea.

Por que uma Fonte de Energia Externa Define os Sinais
Uma célula eletrolítica usa energia elétrica para criar energia química. Esse processo, conhecido como eletrólise, requer uma força externa — uma bateria ou fonte de alimentação CC — para iniciar e sustentar a reação.
O Papel da Fonte de Alimentação
A fonte de alimentação atua como uma "bomba de elétrons". Ela retira elétrons de um eletrodo e os empurra para o outro, criando um desequilíbrio de carga que força os íons na solução eletrolítica a reagir.
O Ânodo é Conectado ao Terminal Positivo
O terminal positivo da fonte de alimentação externa é conectado ao ânodo. Este terminal ativamente retira elétrons do ânodo, deixando-o com uma carga líquida positiva.
O Cátodo é Conectado ao Terminal Negativo
Inversamente, o terminal negativo da fonte de alimentação é conectado ao cátodo. Este terminal ativamente bombeia elétrons para o cátodo, dando-lhe um excesso de elétrons e uma carga líquida negativa.
Como o Movimento Iônico Cria a Reação
As cargas forçadas nos eletrodos são o que atrai os íons dissolvidos no eletrólito, compelindo-os a se mover e reagir. As definições fundamentais de oxidação e redução permanecem constantes.
Ânodo: O Local da Oxidação (Sempre)
Independentemente do tipo de célula, a oxidação (a perda de elétrons) sempre ocorre no ânodo. Em uma célula eletrolítica, íons carregados negativamente (ânions) são atraídos para o ânodo positivo, onde liberam seus elétrons em excesso e são oxidados.
Cátodo: O Local da Redução (Sempre)
Da mesma forma, a redução (o ganho de elétrons) sempre ocorre no cátodo. Íons carregados positivamente (cátions) na solução são atraídos para o cátodo negativo, onde aceitam os elétrons em excesso e são reduzidos.
Uma Distinção Crítica: Células Eletrolíticas vs. Galvânicas
Uma fonte primária de confusão surge ao comparar células eletrolíticas com células galvânicas (ou voltaicas), como uma bateria padrão. Suas convenções de sinais são opostas por uma razão muito específica.
Reações Espontâneas vs. Não Espontâneas
Uma célula galvânica funciona com uma reação química espontânea que produz energia elétrica. Aqui, o ânodo é a fonte natural de elétrons, tornando-o negativo, e o cátodo é onde eles são consumidos, tornando-o positivo.
Uma célula eletrolítica realiza uma reação não espontânea que consome energia elétrica. A fonte de alimentação externa reverte a polaridade natural para forçar a reação a prosseguir.
A Constante Universal
Apesar da diferença nos sinais, os processos centrais são os mesmos em ambos os tipos de células:
- O Ânodo é sempre o local da Oxidação.
- O Cátodo é sempre o local da Redução.
Como Lembrar os Sinais
Use estes princípios para manter as convenções claras com base no seu objetivo.
- Se o seu foco principal for identificar os terminais: Lembre-se de que em uma célula eletrolítica, os sinais correspondem à fonte de alimentação externa: o Ânodo é Positivo e o Cátodo é Negativo.
- Se o seu foco principal for rastrear os íons: Siga a regra simples de cargas opostas: ânions negativos movem-se para o ânodo positivo, e cátions positivos movem-se para o cátodo negativo.
- Se o seu foco principal for distinguir os tipos de células: Associe "eletrolítico" a uma fonte de alimentação externa que força uma carga positiva no ânodo e uma carga negativa no cátodo para impulsionar a reação.
Em última análise, os sinais de uma célula eletrolítica são uma consequência direta de uma fonte de energia externa que anula o fluxo natural de uma reação química.
Tabela de Resumo:
| Eletrodo | Sinal | Processo | Íon Atraído |
|---|---|---|---|
| Ânodo | Positivo (+) | Oxidação | Ânions (negativos) |
| Cátodo | Negativo (-) | Redução | Cátions (positivos) |
Domine seus processos laboratoriais com equipamentos de precisão da KINTEK.
Se você está realizando eletrólise, síntese de materiais ou análise química complexa, ter equipamentos de laboratório confiáveis e precisos é fundamental para obter resultados consistentes e de alta qualidade. A KINTEK é especializada em fornecer equipamentos e consumíveis de laboratório robustos, adaptados às suas necessidades de pesquisa e produção.
Entre em contato com nossos especialistas hoje mesmo para discutir como nossas soluções podem impulsionar suas inovações e aprimorar a eficiência de seus fluxos de trabalho laboratoriais.
Guia Visual
Produtos relacionados
- Célula Eletroquímica Eletrolítica com Cinco Portas
- Célula Eletrolítica de Banho de Água de Cinco Portas de Camada Dupla
- Célula Eletroquímica Eletrolítica de Banho de Água de Dupla Camada
- Célula Eletroquímica Eletrolítica de Quartzo para Experimentos Eletroquímicos
- Célula Eletroquímica Eletrolítica em Banho de Água Óptico
As pessoas também perguntam
- Como evitar a contaminação durante os experimentos com a célula eletrolítica de banho de água de cinco portas? Domine o Protocolo dos 3 Pilares
- Como a célula eletrolítica de banho de água de cinco portas deve ser operada durante um experimento? Domine o Controle Preciso para Resultados Confiáveis
- Qual é a maneira adequada de manusear uma célula eletrolítica de banho-maria de cinco portas? Garanta Experimentos Eletroquímicos Precisos e Seguros
- Como deve ser limpa a célula eletrolítica de banho-maria de cinco portas para manutenção? Um Guia Passo a Passo para Resultados Confiáveis
- De que material é feita a célula eletrolítica de banho-maria de cinco portas? Vidro Borossilicato Alto e PTFE Explicados



















