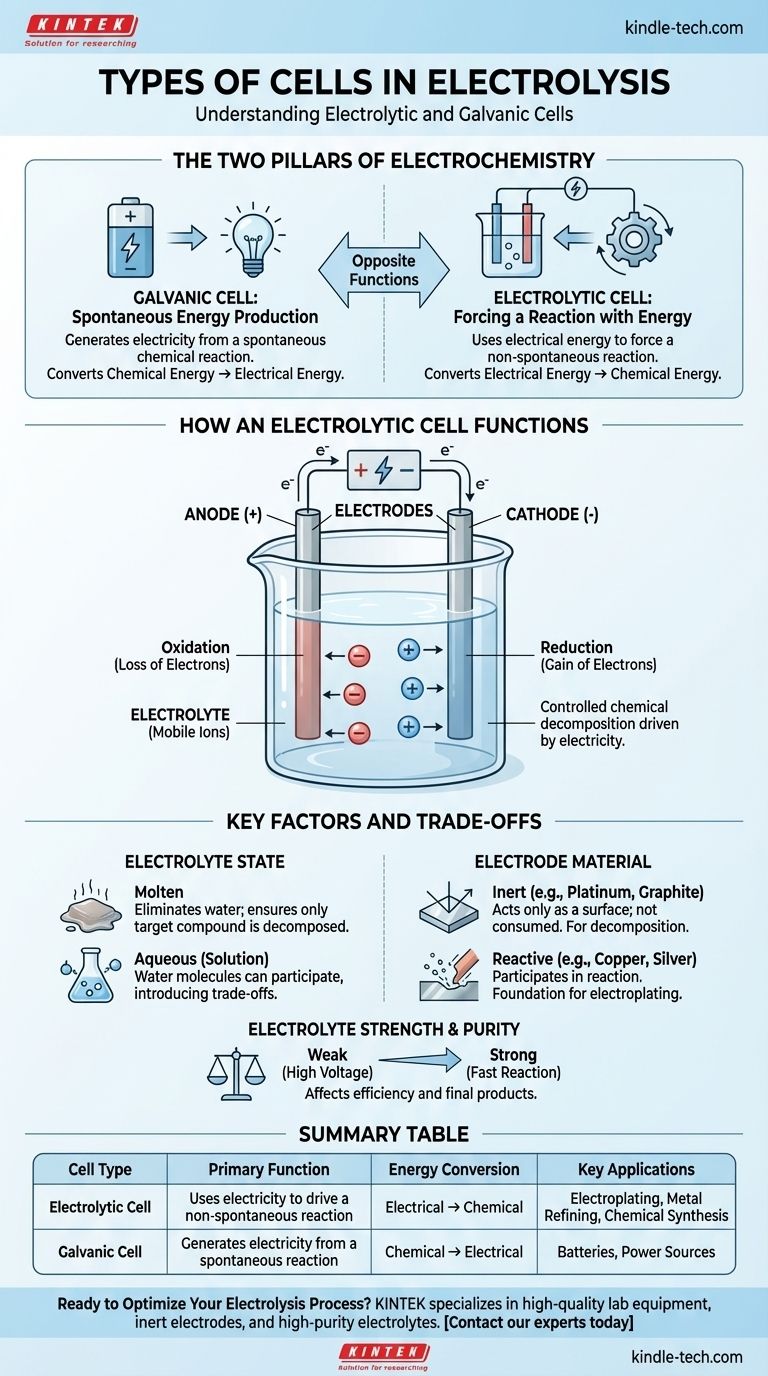
Em sua essência, a eletrólise ocorre dentro de um tipo específico de célula eletroquímica conhecida como célula eletrolítica. Esta célula é um dos dois tipos fundamentais de células eletroquímicas, sendo a outra uma célula galvânica. Uma célula eletrolítica usa energia elétrica para forçar uma reação química não espontânea, enquanto uma célula galvânica faz o oposto, gerando eletricidade a partir de uma reação química espontânea.
A distinção crítica é o propósito. Uma célula galvânica (como uma bateria) produz eletricidade a partir de uma reação química. Uma célula eletrolítica usa eletricidade para impulsionar uma reação química que não ocorreria por si só.

Os Dois Pilares da Eletroquímica
Para entender a célula usada para eletrólise, você deve primeiro entender sua contraparte. Ambos os tipos de células são fundamentais para a eletroquímica, mas servem a funções opostas.
A Célula Galvânica: Produção Espontânea de Energia
Uma célula galvânica é o que comumente conhecemos como bateria. Ela aproveita uma reação química espontânea que naturalmente deseja ocorrer.
À medida que esta reação prossegue, ela libera energia na forma de corrente elétrica. Ela converte diretamente a energia química armazenada em energia elétrica.
A Célula Eletrolítica: Forçando uma Reação com Energia
Uma célula eletrolítica é o motor da eletrólise. Ela é projetada para fazer uma reação química não espontânea acontecer, fornecendo energia externa.
Você aplica uma corrente elétrica de uma fonte externa (como uma fonte de alimentação) à célula. Isso força a decomposição de uma substância, convertendo efetivamente a energia elétrica de volta em energia química, criando novas substâncias.
Como Funciona uma Célula Eletrolítica
O processo de eletrólise é uma decomposição química controlada impulsionada pela eletricidade. Isso requer alguns componentes-chave trabalhando em conjunto.
Os Componentes Essenciais
Uma célula eletrolítica consiste em dois eletrodos (um ânodo positivo e um cátodo negativo) submersos em um eletrólito. Uma fonte de energia externa é conectada a esses eletrodos, criando um circuito.
O Papel do Eletrólito
O eletrólito é a substância que será decomposta. É tipicamente um composto iônico, seja em estado fundido ou dissolvido em uma solução (aquosa).
Esta substância deve conter íons móveis que são livres para se mover e transportar uma carga. Os eletrólitos são geralmente soluções de ácidos, bases ou sais.
A Função dos Eletrodos
Os eletrodos são os condutores através dos quais a eletricidade entra e sai do eletrólito.
- Ânodo: O eletrodo positivo. Ele atrai íons negativos (ânions), onde ocorre a oxidação (perda de elétrons).
- Cátodo: O eletrodo negativo. Ele atrai íons positivos (cátions), onde ocorre a redução (ganho de elétrons).
A fonte de energia externa é o que mantém essa separação de carga e impulsiona todo o processo.
Compreendendo os Fatores Chave e as Compensações
O resultado da eletrólise não é automático. Os produtos específicos que você cria dependem inteiramente dos materiais e condições que você escolher.
Estado do Eletrólito: Fundido vs. Aquoso
O estado do eletrólito é uma decisão crítica. Se você usar uma solução aquosa (dissolvida em água), as próprias moléculas de água podem participar da reação.
Isso introduz uma compensação, pois a eletricidade pode dividir a água em vez do composto dissolvido, dependendo de qual reação é mais fácil de impulsionar. O uso de um eletrólito fundido elimina a água da equação, garantindo que apenas o composto alvo seja decomposto.
Material do Eletrodo: Inerte vs. Reativo
Os eletrodos podem ser participantes passivos ou ativos na reação.
- Eletrodos Inertes (por exemplo, Platina, Grafite): Estes atuam apenas como uma superfície para a reação acontecer. Eles não são consumidos e são usados quando se deseja decompor o próprio eletrólito, como na divisão da água em hidrogênio e oxigênio.
- Eletrodos Reativos (por exemplo, Cobre, Prata): Estes podem se dissolver ou participar da reação química. Este é o princípio por trás da galvanoplastia, onde o ânodo se dissolve e seus íons metálicos são depositados no objeto no cátodo.
Força e Pureza do Eletrólito
A eficiência da eletrólise também é influenciada pelo eletrólito. Eletrólitos fortes, que se dissociam completamente em íons, conduzem bem a eletricidade e permitem uma reação mais rápida.
Eletrólitos fracos requerem mais energia (uma voltagem mais alta) para iniciar e sustentar a reação. A presença de outros agentes oxidantes ou redutores no eletrólito também pode alterar os produtos finais.
Aplicando Isso ao Seu Objetivo
Compreender a função de uma célula eletrolítica permite controlar reações químicas para propósitos industriais e científicos específicos.
- Se o seu foco principal é produzir uma substância pura: Selecione um eletrodo inerte e um eletrólito de alta pureza (fundido ou aquoso) para garantir a decomposição do composto alvo, como na produção de alumínio a partir de minério de bauxita.
- Se o seu foco principal é revestir ou purificar um metal: Use um ânodo reativo feito do material de revestimento e um eletrólito contendo íons desse mesmo metal. Esta é a base da galvanoplastia e do eletrorefino.
- Se o seu foco principal é gerar eletricidade: Você precisa de uma célula galvânica, não uma eletrolítica, pois sua função é liberar energia de uma reação espontânea.
Em última análise, a eletrólise fornece um método poderoso para usar energia elétrica para controlar e impulsionar precisamente a mudança química.
Tabela Resumo:
| Tipo de Célula | Função Primária | Conversão de Energia | Aplicações Chave |
|---|---|---|---|
| Célula Eletrolítica | Usa eletricidade para impulsionar uma reação não espontânea | Elétrica → Química | Galvanoplastia, Refino de Metais, Síntese Química |
| Célula Galvânica | Gera eletricidade a partir de uma reação espontânea | Química → Elétrica | Baterias, Fontes de Energia |
Pronto para Otimizar Seu Processo de Eletrólise?
Compreender o tipo certo de célula e seus componentes é crucial para uma galvanoplastia, refino de metais ou síntese química eficientes. A KINTEK é especializada no fornecimento de equipamentos e consumíveis de laboratório de alta qualidade, incluindo eletrodos inertes e eletrólitos de alta pureza, para garantir que seus processos eletrolíticos sejam precisos e eficazes.
Entre em contato com nossos especialistas hoje para discutir sua aplicação específica e descobrir como nossas soluções podem aprimorar as capacidades e resultados do seu laboratório.
Guia Visual
Produtos relacionados
- Célula Eletroquímica Eletrolítica com Cinco Portas
- Célula Eletroquímica Eletrolítica de Quartzo para Experimentos Eletroquímicos
- Célula Eletrolítica Eletroquímica Óptica de Dupla Camada Tipo H com Banho de Água
- Célula Eletrolítica Tipo H Tripla Eletroquímica
- Célula Eletrolítica de PTFE Célula Eletroquímica Resistente à Corrosão Selada e Não Selada
As pessoas também perguntam
- Como devem ser manuseados os componentes de vidro da célula eletrolítica? Um Guia para Prevenir Quebras e Garantir a Segurança
- Uma célula eletrolítica também é conhecida como? Entendendo as Células Eletrolíticas vs. Galvânicas
- Qual é o procedimento de limpeza para uma célula de eletrólise previamente utilizada? Garanta a Pureza para Resultados Confiáveis
- O que é importante em relação ao controle de temperatura para a célula eletrolítica tipo H? Garanta Precisão e Integridade dos Dados
- Quais são as vantagens de usar uma célula eletrolítica de três eletrodos? Obtenha precisão na análise de aço inoxidável
- Qual é a função principal de uma célula eletrolítica de três eletrodos? Isolar e Otimizar o Desempenho do Dispositivo PEC
- Como uma célula eletrolítica eletroquímica de três eletrodos é utilizada para avaliar a resistência à corrosão da liga Zr-Nb?
- Como o equipamento de oxidação anódica facilita o crescimento de nanotubos de TiO2? Controle de Precisão para Ligas de Titânio Avançadas



















