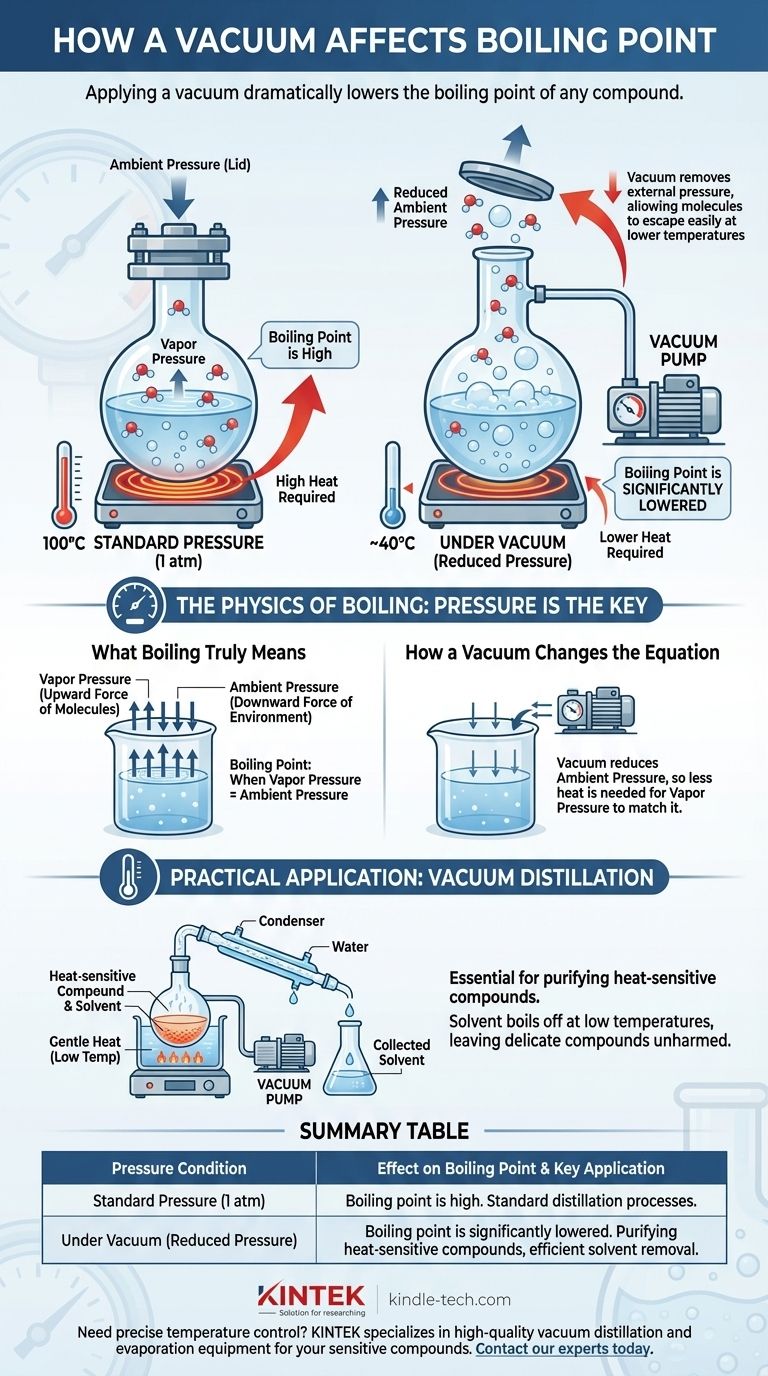
Em resumo, a aplicação de vácuo reduz drasticamente o ponto de ebulição de qualquer composto. A ebulição não é uma temperatura fixa, mas sim o ponto em que a pressão de vapor interna de um líquido se iguala à pressão externa que pressiona sua superfície. Ao criar um vácuo, você remove essa pressão externa, tornando muito mais fácil para as moléculas escaparem da fase líquida e se transformarem em gás a uma temperatura muito mais baixa.
O ponto de ebulição de um líquido não é uma constante; é uma função direta da pressão circundante. A redução dessa pressão com um vácuo diminui a energia necessária para as moléculas transitarem para o estado gasoso, fazendo com que a substância ferva a uma temperatura significativamente reduzida.

A Física da Ebulição: A Pressão é a Chave
Para entender por que o vácuo tem um efeito tão poderoso, devemos primeiro redefinir o que realmente é "ebulição". É menos sobre uma temperatura específica e mais sobre uma batalha de pressões.
O Que a Ebulição Realmente Significa
A ebulição é o estado físico específico em que a pressão de vapor de um líquido se torna igual à pressão ambiente do seu ambiente.
Neste ponto de equilíbrio, bolhas de vapor podem se formar dentro do volume do líquido e subir à superfície. Isso é fundamentalmente diferente da simples evaporação, que ocorre apenas na superfície do líquido.
O Papel da Pressão de Vapor
Todo líquido exerce uma certa pressão de vapor, que é a força inerente de suas moléculas tentando escapar para a fase gasosa.
À medida que você aquece um líquido, suas moléculas ganham energia cinética. Esse aumento de energia faz com que elas pressionem mais contra os arredores, e, portanto, a pressão de vapor aumenta com a temperatura.
Como a Pressão Ambiente Atua como uma "Tampa"
A atmosfera ao nosso redor exerce uma pressão constante sobre tudo, incluindo a superfície dos líquidos. Você pode pensar nessa pressão ambiente como uma "tampa" física que mantém as moléculas do líquido no lugar.
Para que um líquido ferva, sua pressão de vapor deve se tornar forte o suficiente para "empurrar a tampa". Ao nível do mar (1 atmosfera de pressão), a água deve atingir 100°C (212°F) para gerar pressão de vapor suficiente para realizar isso.
Como um Vácuo Altera a Equação
Uma bomba de vácuo funciona removendo moléculas de gás de um sistema selado, reduzindo drasticamente a pressão ambiente. Isso altera fundamentalmente as condições necessárias para a ebulição.
Removendo a "Tampa"
Aplicar um vácuo é o equivalente a levantar essa "tampa" de pressão. Com menos moléculas de gás pressionando a superfície do líquido, as moléculas podem escapar muito mais facilmente.
Esta é a mesma razão pela qual a água ferve a uma temperatura mais baixa em altitudes elevadas. A pressão atmosférica é menor em uma montanha, então é necessário menos calor para que a pressão de vapor da água a iguale.
O Novo Ponto de Ebulição Mais Baixo
Como a pressão externa é agora muito menor, o líquido não precisa de tanta energia de calor para elevar sua pressão de vapor ao ponto de ebulição.
O resultado é que a substância ferverá a uma temperatura muito abaixo do seu ponto de ebulição padrão. Por exemplo, sob um vácuo forte o suficiente, a água pode ser feita para ferver à temperatura ambiente.
Aplicação Prática: Destilação a Vácuo
Este princípio é essencial em química para purificar compostos sensíveis ao calor. Um químico pode colocar uma mistura sob vácuo e aquecê-la suavemente.
Um solvente volátil evaporará a uma temperatura muito baixa, deixando para trás o composto desejado e mais delicado, que nunca é exposto a calor elevado potencialmente prejudicial.
Entendendo as Compensações e Armadilhas
Embora poderoso, usar um vácuo para diminuir o ponto de ebulição não é isento de desafios e requer consideração cuidadosa.
Risco de "Bumping" (Efervescência Violenta)
Sob vácuo, os líquidos podem ferver explosivamente em um fenômeno chamado bumping. O aquecimento irregular pode fazer com que uma porção do líquido fique superaquecida, transformando-se repentinamente em vapor com força violenta. Isso é tipicamente gerenciado usando pedras de ebulição ou agitação constante.
Dificuldade com Substâncias de Baixa Volatilidade
Para substâncias com forças intermoleculares muito fracas e, portanto, pressões de vapor muito baixas (como óleos ou líquidos iônicos), mesmo um vácuo alto pode não reduzir o ponto de ebulição o suficiente para evitar a decomposição térmica. Há um limite prático para a utilidade da técnica.
Integridade do Equipamento e Vedação
Atingir e manter um vácuo profundo requer bombas especializadas e vidrarias ou recipientes perfeitamente vedados. Mesmo um pequeno vazamento pode comprometer a pressão do sistema, fazendo com que o ponto de ebulição aumente inesperadamente.
Fazendo a Escolha Certa para o Seu Objetivo
Manipular a pressão é uma ferramenta, e sua aplicação depende inteiramente do seu objetivo.
- Se o seu foco principal é purificar um composto sensível ao calor: Use destilação a vácuo para separar componentes em temperaturas que evitem a decomposição ou reações colaterais indesejadas.
- Se o seu foco principal é remover um solvente de forma eficiente: Aplique vácuo, muitas vezes com rotação (como em um evaporador rotativo), para evaporar rapidamente os solventes sem a necessidade de calor elevado.
- Se o seu foco principal é desidratar um material delicado: Use um vácuo profundo para reduzir o ponto de ebulição/sublimação da água, permitindo a desidratação em baixas temperaturas (liofilização) que preserva a estrutura do material.
Em última análise, entender a relação entre pressão e temperatura lhe dá controle preciso sobre o estado físico de uma substância.
Tabela de Resumo:
| Condição de Pressão | Efeito no Ponto de Ebulição | Aplicação Principal |
|---|---|---|
| Pressão Padrão (1 atm) | O ponto de ebulição está em sua temperatura padrão e alta. | Processos de destilação padrão. |
| Sob Vácuo (Pressão Reduzida) | O ponto de ebulição é significativamente reduzido. | Purificação de compostos sensíveis ao calor, remoção eficiente de solventes. |
Precisa de controle preciso de temperatura para seus compostos sensíveis? A KINTEK é especializada em equipamentos de destilação a vácuo e evaporação de alta qualidade, incluindo evaporadores rotativos, projetados para proteger seus materiais delicados ao reduzir os pontos de ebulição. Nossos equipamentos de laboratório garantem um processamento eficiente e seguro para pesquisadores e profissionais de laboratório. Contate nossos especialistas hoje para encontrar a solução de vácuo perfeita para sua aplicação!
Guia Visual
Produtos relacionados
- Bomba de Vácuo de Água Circulante para Uso Laboratorial e Industrial
- Bomba de Vácuo Rotativa de Palhetas de Laboratório para Uso em Laboratório
- Bomba de Vácuo de Diafragma Sem Óleo para Uso Laboratorial e Industrial
- Prensa Térmica Hidráulica Elétrica a Vácuo para Laboratório
- Válvula de Esfera a Vácuo e Válvula de Bloqueio em Aço Inoxidável 304 316 para Sistemas de Alto Vácuo
As pessoas também perguntam
- Como uma bomba de vácuo de água circulante é utilizada para resíduos de produção de hidrogênio? Otimize sua separação sólido-líquido
- Como funciona uma bomba de vácuo de circulação de água? Descubra o Princípio Eficiente do Pistão Líquido
- Qual é a importância de uma bomba de vácuo para interfaces híbridas do tipo Schottky? Alcance Pureza e Ligação em Nível Atômico
- Como a rotação do rotor afeta o fluxo de gás em uma bomba de vácuo de circulação de água? Um Guia para o Princípio do Anel Líquido
- Para que posso usar uma bomba de vácuo? Potencializando Processos Industriais da Embalagem à Automação



















