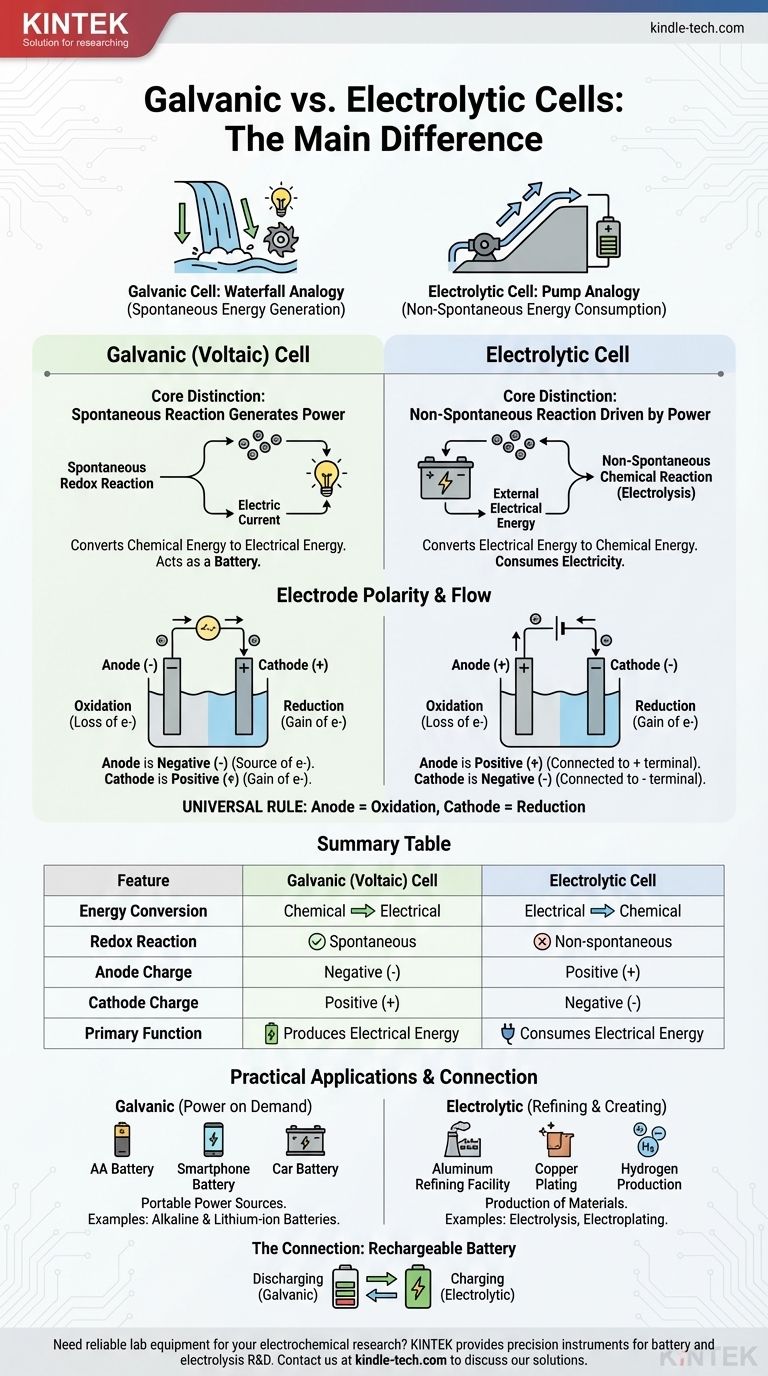
A diferença fundamental reside na direção da conversão de energia e na natureza da reação química. Uma célula galvânica converte espontaneamente energia química armazenada em energia elétrica, funcionando efetivamente como uma bateria. Em contraste, uma célula eletrolítica usa uma fonte externa de energia elétrica para forçar a ocorrência de uma reação química não espontânea.
Pense nisso como a diferença entre uma cachoeira gerando energia e uma bomba usando energia. Uma célula galvânica é como uma cachoeira, onde um processo natural e espontâneo (água fluindo para baixo) cria energia. Uma célula eletrolítica é como uma bomba, usando energia externa para forçar um processo que não ocorreria por conta própria (empurrar a água para cima).

A Distinção Central: Espontaneidade e Fluxo de Energia
O comportamento dessas duas células é regido por um princípio: se a reação redox interna acontece por conta própria.
Células Galvânicas: Reações Espontâneas que Geram Energia
Em uma célula galvânica, também conhecida como célula voltaica, os reagentes químicos escolhidos têm uma tendência natural de reagir entre si.
Esta reação redox espontânea libera energia. A célula é construída para canalizar essa energia não como calor, mas como um fluxo direcionado de elétrons — uma corrente elétrica.
Essencialmente, uma célula galvânica aproveita um processo químico natural para realizar trabalho elétrico. Este é o princípio por trás de todas as baterias.
Células Eletrolíticas: Reações Não Espontâneas Impulsionadas por Energia
Em uma célula eletrolítica, a reação química é não espontânea. Os reagentes não interagirão por conta própria para produzir os produtos desejados.
Para que a reação ocorra, uma fonte de energia externa (como uma bateria ou fonte de alimentação) é conectada à célula. Essa voltagem externa fornece a energia necessária para forçar os elétrons a se moverem e impulsionar a mudança química.
Células eletrolíticas consomem eletricidade para criar um produto químico, um processo conhecido como eletrólise.
Uma Análise Mais Profunda da Polaridade dos Eletrodos
Embora os termos "ânodo" e "cátodo" sejam constantes, sua carga (polaridade) é um ponto comum de confusão porque é invertida entre os dois tipos de célula. O segredo é lembrar o que impulsiona o fluxo de elétrons.
O Ânodo: Sempre o Local da Oxidação
Em ambos os tipos de célula, o ânodo é definido como o eletrodo onde ocorre a oxidação (a perda de elétrons). Esta definição é universal.
O Cátodo: Sempre o Local da Redução
Da mesma forma, o cátodo é sempre o eletrodo onde ocorre a redução (o ganho de elétrons). Esta é a segunda regra universal.
A Mudança Crítica: Por Que a Polaridade se Inverte
A diferença na polaridade decorre se a reação é espontânea ou forçada.
Em uma célula galvânica, a oxidação espontânea no ânodo libera elétrons, criando uma carga negativa. O ânodo é o terminal negativo porque é a fonte de elétrons que saem para o circuito.
Em uma célula eletrolítica, uma fonte de energia externa é usada. Seu terminal positivo puxa elétrons do ânodo para forçar a oxidação. Portanto, o ânodo é conectado ao lado positivo e se torna o terminal positivo.
| Característica | Célula Galvânica (Voltaica) | Célula Eletrolítica |
|---|---|---|
| Conversão de Energia | Química para Elétrica | Elétrica para Química |
| Reação Redox | Espontânea | Não espontânea |
| Carga do Ânodo | Negativa (-) | Positiva (+) |
| Carga do Cátodo | Positiva (+) | Negativa (-) |
| Função Principal | Produz Energia Elétrica | Consome Energia Elétrica |
Compreendendo as Aplicações Práticas
Essa diferença fundamental leva a usos distintos na tecnologia e na indústria.
Células Galvânicas em Ação: Energia Sob Demanda
Células galvânicas são projetadas para serem fontes portáteis de energia elétrica. Exemplos comuns incluem todos os tipos de baterias, desde pilhas alcalinas AA padrão até a bateria de íon-lítio no seu telefone.
Células Eletrolíticas em Funcionamento: Refino e Criação
Células eletrolíticas usam energia para produzir materiais. Processos industriais chave dependem da eletrólise, como a produção de alumínio puro a partir de seu minério, o refino de cobre e a separação da água para produzir gás hidrogênio e oxigênio. A galvanoplastia, onde uma fina camada de metal como prata ou cromo é depositada sobre outro objeto, é outra aplicação comum.
A Conexão: Como Funciona uma Bateria Recarregável
Uma bateria recarregável é a ilustração perfeita de ambos os tipos de célula em um único dispositivo.
Quando está alimentando seu dispositivo (descarregando), ela está operando como uma célula galvânica. Uma reação química espontânea dentro da bateria produz uma corrente elétrica.
Quando você a conecta para carregar, o carregador atua como uma fonte de energia externa. Ele aplica uma voltagem que força a ocorrência da reação reversa não espontânea, reabastecendo os reagentes. Durante o carregamento, a bateria está funcionando como uma célula eletrolítica.
Fazendo a Escolha Certa para o Seu Objetivo
Seu objetivo determina qual estrutura eletroquímica você está usando.
- Se seu foco principal é gerar eletricidade a partir de um processo químico: Você está descrevendo uma célula galvânica (voltaica).
- Se seu foco principal é usar eletricidade para impulsionar uma mudança química específica: Você está trabalhando com uma célula eletrolítica.
- Se você está analisando uma bateria recarregável: Lembre-se de que ela opera como uma célula galvânica durante a descarga e como uma célula eletrolítica durante o recarregamento.
Em última análise, a espontaneidade da reação e a direção resultante do fluxo de energia são as características definidoras que separam esses dois pilares da eletroquímica.
Tabela de Resumo:
| Característica | Célula Galvânica (Voltaica) | Célula Eletrolítica |
|---|---|---|
| Conversão de Energia | Química para Elétrica | Elétrica para Química |
| Reação Redox | Espontânea | Não espontânea |
| Carga do Ânodo | Negativa (-) | Positiva (+) |
| Carga do Cátodo | Positiva (+) | Negativa (-) |
| Função Principal | Produz Energia Elétrica | Consome Energia Elétrica |
Precisa de equipamentos de laboratório confiáveis para sua pesquisa eletroquímica? Quer você esteja desenvolvendo novas tecnologias de baterias ou otimizando processos de eletrólise, a KINTEK fornece os instrumentos de precisão e consumíveis que seu laboratório exige. Entre em contato conosco hoje para discutir como nossas soluções podem impulsionar suas inovações!
Guia Visual
Produtos relacionados
- Célula Eletrolítica Eletroquímica para Avaliação de Revestimentos
- Célula Eletroquímica Eletrolítica com Cinco Portas
- Célula Eletrolítica Eletroquímica Óptica de Dupla Camada Tipo H com Banho de Água
- Célula de Gás de Eletrólise Eletroquímica Eletrolítica Célula de Reação de Fluxo Líquido
- Banho de Água de Célula Eletroquímica Eletrolítica Multifuncional Camada Única Dupla Camada
As pessoas também perguntam
- Qual é a faixa de volume da célula eletrolítica para avaliação de revestimento? Um guia para escolher o tamanho certo
- Como o sistema de célula eletroquímica garante a precisão da medição durante os testes de Reativação Eletroquímica Potencioscinética de Duplo Ciclo (DL-EPR) de aço inoxidável super duplex?
- Qual é o princípio de funcionamento de uma célula eletrolítica de corrosão de placa plana? Um Guia para Testes Controlados de Materiais
- Como uma célula eletrolítica de alta precisão é usada para avaliar a resistência à corrosão de metais? Valide os resultados do DCT com precisão
- Como uma célula eletrolítica eletroquímica de três eletrodos é utilizada para avaliar a resistência à corrosão da liga Zr-Nb?















