Em essência, a eletrólise é o processo de usar energia elétrica para impulsionar uma reação química que não ocorreria por si mesma. Uma fonte de energia externa aplica uma voltagem através de dois eletrodos submersos em uma solução condutora ou sal fundido, chamado eletrólito. Essa energia aplicada força os íons a migrarem para eletrodos com cargas opostas, onde sofrem decomposição através de reações de oxidação e redução.
Uma célula eletrolítica é um motor para reverter reações químicas. Ao aplicar energia externa, ela força os elétrons a fluírem contra sua tendência natural, compelindo compostos químicos estáveis a se decomporem em seus elementos constituintes.

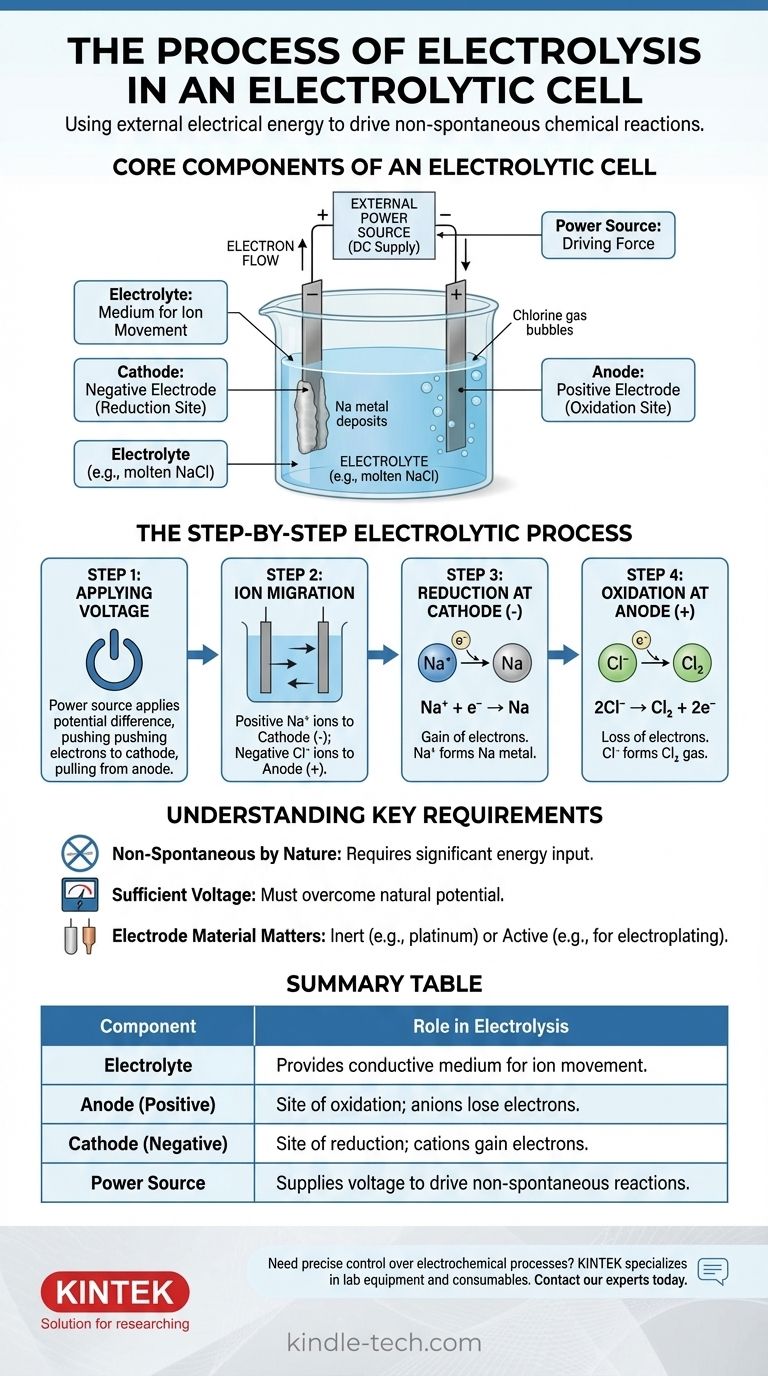
Os Componentes Essenciais de uma Célula Eletrolítica
Para entender o processo, você deve primeiro entender a função de cada parte. O sistema é uma interação cuidadosamente orquestrada entre três componentes-chave.
O Eletrólito: Um Meio para o Movimento de Íons
O eletrólito é uma substância que contém íons de movimento livre, o que o torna eletricamente condutor. É tipicamente um composto iônico fundido, como cloreto de sódio (NaCl), ou uma solução aquosa contendo íons dissolvidos.
O único propósito do eletrólito é fornecer um meio através do qual os íons carregados possam viajar entre os eletrodos.
Os Eletrodos: Ânodo e Cátodo
Os eletrodos são materiais condutores (geralmente metais ou grafite) que são submersos no eletrólito. Eles servem como a interface física onde o circuito elétrico encontra a solução química.
Em uma célula eletrolítica, a polaridade é definida pela fonte de energia externa:
- O Ânodo é o eletrodo positivo.
- O Cátodo é o eletrodo negativo.
A Fonte de Energia Externa: A Força Impulsionadora
Esta é tipicamente uma bateria ou fonte de alimentação CC. Sua função é criar uma diferença de potencial entre os eletrodos, forçando os elétrons a se moverem em uma direção que não fariam espontaneamente.
Essa voltagem externa é a "bomba" que impulsiona toda a reação não espontânea, superando a estabilidade química natural do eletrólito.
O Processo Eletrolítico Passo a Passo
O processo se desenrola em uma sequência precisa uma vez que a fonte de energia é ativada. Podemos ilustrar isso usando o exemplo de cloreto de sódio fundido (NaCl).
Etapa 1: Aplicação da Voltagem
Uma voltagem externa é aplicada. A fonte de energia empurra elétrons para um eletrodo, tornando-o negativamente carregado (o cátodo), e puxa elétrons do outro, tornando-o positivamente carregado (o ânodo).
Etapa 2: Migração de Íons
Dentro do eletrólito de NaCl fundido, o sódio existe como íons positivos (cátions, Na⁺) e o cloreto existe como íons negativos (ânions, Cl⁻).
Opostos se atraem: os cátions Na⁺ positivos são atraídos para o cátodo negativo, enquanto os ânions Cl⁻ negativos são atraídos para o ânodo positivo.
Etapa 3: Redução no Cátodo (O Eletrodo Negativo)
Quando os cátions Na⁺ atingem o cátodo negativamente carregado, cada um deles ganha um elétron fornecido pela fonte de energia. Esse ganho de elétrons é uma reação de redução.
Os íons Na⁺ são reduzidos para formar sódio metálico neutro (Na), que se deposita no cátodo.
Etapa 4: Oxidação no Ânodo (O Eletrodo Positivo)
Simultaneamente, quando os ânions Cl⁻ atingem o ânodo positivamente carregado, cada um deles cede um elétron ao eletrodo. Essa perda de elétrons é uma reação de oxidação.
Os íons Cl⁻ são oxidados para formar átomos de cloro neutros, que se unem para formar gás cloro (Cl₂) que borbulha para fora do ânodo. Os elétrons liberados viajam através do circuito externo de volta à fonte de energia, completando o circuito.
Compreendendo os Requisitos Essenciais
A eletrólise é poderosa, mas opera sob restrições específicas. Ignorá-las pode levar a experimentos falhos ou à incompreensão dos resultados.
Não Espontânea por Natureza
O princípio central é que a eletrólise impulsiona uma reação não espontânea. A decomposição do sal em sódio metálico e gás cloro, por exemplo, requer uma entrada significativa de energia. Sem a voltagem externa, nada aconteceria.
A Necessidade de Voltagem Suficiente
A fonte de energia externa deve fornecer uma voltagem alta o suficiente para superar o potencial natural da reação química. Se a voltagem for muito baixa, não será forte o suficiente para forçar a migração iônica e a transferência de elétrons, e a reação não prosseguirá.
O Material do Eletrodo Importa
Para decomposição simples, são usados eletrodos inertes (como platina ou carbono). Esses materiais facilitam a transferência de elétrons sem participar da própria reação. Em outras aplicações, como eletrodeposição, o ânodo pode ser um eletrodo "ativo" projetado para ser oxidado e dissolvido no eletrólito.
Aplicando Isso a Exemplos Comuns
Os princípios da eletrólise são universais, mas os produtos específicos dependem inteiramente do eletrólito utilizado.
- Se o seu objetivo é produzir metais puros: Use um sal fundido desse metal como eletrólito. O metal puro será reduzido e depositado no cátodo, como visto na produção industrial de sódio e alumínio.
- Se o seu objetivo é decompor água: Use água com uma pequena quantidade de um ácido ou sal para melhorar a condutividade. Este processo produzirá gás hidrogênio (H₂) no cátodo e gás oxigênio (O₂) no ânodo.
- Se o seu objetivo é eletrodepositar um objeto: O objeto a ser revestido é definido como o cátodo. Íons metálicos da solução eletrolítica são reduzidos na superfície do objeto, formando um revestimento metálico fino e uniforme.
Ao controlar o fluxo de elétrons, podemos controlar e reverter diretamente processos químicos, uma capacidade fundamental que sustenta grande parte da indústria moderna.
Tabela Resumo:
| Componente | Função na Eletrólise |
|---|---|
| Eletrólito | Fornece meio condutor para o movimento de íons (por exemplo, NaCl fundido). |
| Ânodo (Positivo) | Local de oxidação; ânions perdem elétrons (por exemplo, Cl⁻ → gás Cl₂). |
| Cátodo (Negativo) | Local de redução; cátions ganham elétrons (por exemplo, Na⁺ → metal Na). |
| Fonte de Energia | Fornece voltagem para impulsionar reações não espontâneas. |
Precisa de controle preciso sobre processos eletroquímicos? A KINTEK é especializada em equipamentos de laboratório e consumíveis para eletrólise, eletrodeposição e síntese de materiais. Nossas fontes de alimentação confiáveis, eletrodos e soluções eletrolíticas ajudam você a obter resultados consistentes – seja decompondo compostos, refinando metais ou revestindo superfícies. Entre em contato com nossos especialistas hoje para discutir as necessidades específicas do seu laboratório!
Guia Visual
Produtos relacionados
- Célula Eletroquímica Eletrolítica de Quartzo para Experimentos Eletroquímicos
- Célula Eletrolítica Eletroquímica Óptica de Dupla Camada Tipo H com Banho de Água
- Célula de Gás de Eletrólise Eletroquímica Eletrolítica Célula de Reação de Fluxo Líquido
- Célula de Fluxo de Redução de CO2 Personalizável para Pesquisa em NRR, ORR e CO2RR
- Caixa de Bateria Li-Ar para Aplicações de Laboratório de Baterias
As pessoas também perguntam
- Que precauções devem ser tomadas ao manusear e usar uma célula eletrolítica de quartzo puro? Garanta um Desempenho Seguro, Preciso e Durável
- Quais são as principais aplicações da célula eletrolítica totalmente de quartzo? Essencial para Análise de Alta Pureza e Óptica
- Quais são as etapas necessárias para preparar uma célula eletrolítica totalmente de quartzo antes de um experimento? Garanta precisão e segurança
- Qual é o procedimento adequado para a limpeza pós-experimento e armazenamento de uma célula eletrolítica totalmente em quartzo? Garanta a Longevidade e a Reprodutibilidade
- Que materiais são usados para construir a célula eletrolítica de quartzo puro? Um Guia para Pureza e Desempenho



















