Em resumo, o eletrodo de platina em um Eletrodo Padrão de Hidrogênio (SHE) funciona como uma superfície inerte e cataliticamente ativa. Ele fornece o local físico onde a reação de hidrogênio pode ocorrer e diminui a energia de ativação necessária, permitindo que a célula atinja um equilíbrio estável e mensurável sem que o próprio eletrodo seja consumido.
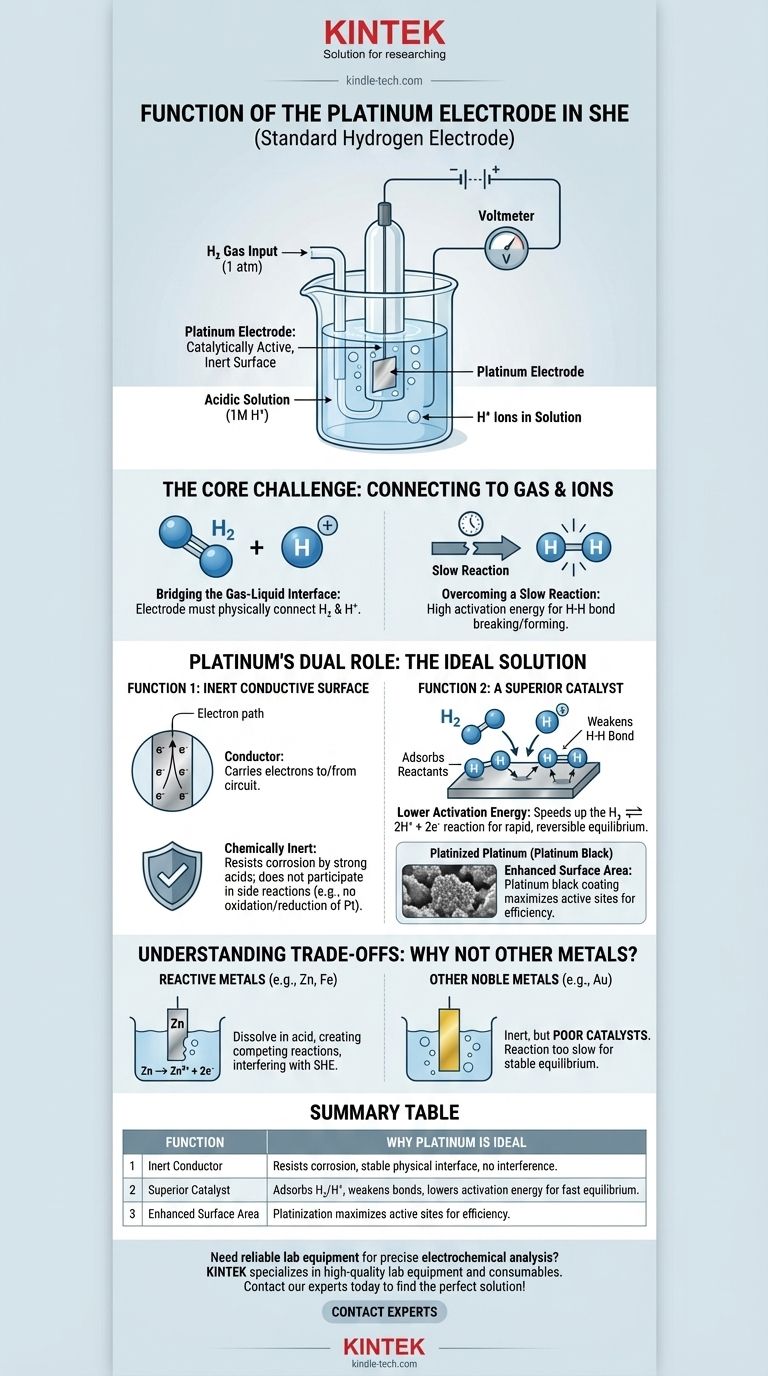
O principal desafio do SHE é criar uma conexão elétrica confiável para uma reação envolvendo um gás (H₂) e um íon (H⁺). A platina é excepcionalmente adequada para essa função porque é um excelente catalisador para a reação de hidrogênio e um condutor quimicamente inerte, garantindo que ela facilite a reação sem interferir nela.

O Desafio Principal: Conectar um Circuito a um Gás
Para entender a função da platina, devemos primeiro reconhecer o problema fundamental na construção de um Eletrodo Padrão de Hidrogênio. O objetivo é medir o potencial da reação redox do hidrogênio: 2H⁺(aq) + 2e⁻ ⇌ H₂(g).
Ponte na Interface Gás-Líquido
A reação envolve íons de hidrogênio dissolvidos em uma solução ácida e gás hidrogênio borbulhado sobre o eletrodo. Um eletrodo deve existir fisicamente neste ambiente para fornecer ou aceitar elétrons de um circuito externo.
Superando uma Reação Lenta
Esta reação de hidrogênio não ocorre de forma rápida ou eficiente por si só. A energia necessária para quebrar a ligação H-H em uma molécula de hidrogênio ou para combinar dois íons de hidrogênio é alta. Sem ajuda, o sistema não atingiria um equilíbrio rápido e reversível, tornando-o inútil como padrão de referência.
Duplo Papel da Platina: A Solução Ideal
A platina é escolhida porque resolve ambos os problemas simultaneamente. Ela atua como um condutor físico inerte e um catalisador químico ativo.
Função 1: Uma Superfície Condutora Inerte
Primeiro, o eletrodo deve ser um condutor para transportar elétrons para ou do circuito externo. Crucialmente, ele também deve ser quimicamente inerte.
Ele não pode reagir com o ácido forte (tipicamente 1M HCl) ou ser oxidado ou reduzido. A platina é um metal nobre, o que significa que é extremamente resistente à corrosão e dissolução, tornando-a a base física estável perfeita para o eletrodo.
Função 2: Um Catalisador Superior
Esta é a função mais crítica da platina. Ela acelera drasticamente a reação redox do hidrogênio.
A superfície da platina adsorve tanto as moléculas de gás hidrogênio (H₂) quanto os íons de hidrogênio (H⁺). Pense na superfície da platina como uma bancada que mantém os reagentes no lugar, facilitando a interação entre eles.
Ao adsorver gás hidrogênio, a superfície da platina enfraquece a forte ligação H-H covalente, tornando muito mais fácil dividir a molécula em átomos individuais que podem então ser oxidados a íons H⁺. Esta ação catalítica é o que permite que a reação prossiga rapidamente e reversivelmente.
O Papel da "Platina Platinizada"
Para maximizar esse efeito, o eletrodo é frequentemente revestido com uma camada de pó de platina finamente dividido, conhecido como negro de platina. Este processo, chamado platinização, aumenta drasticamente a área de superfície efetiva do eletrodo, fornecendo muito mais locais ativos para catálise e garantindo que o eletrodo funcione de forma eficiente.
Compreendendo as Trocas: Por Que Não Outros Metais?
Examinar por que outros metais falham ajuda a esclarecer por que a platina é a escolha definitiva.
O Problema com Metais Reativos
Metais como zinco, ferro ou alumínio são altamente reativos. Se colocados na solução ácida do SHE, eles simplesmente se dissolveriam (Zn → Zn²⁺ + 2e⁻). Isso cria uma reação eletroquímica concorrente que interferiria completamente na função do eletrodo de hidrogênio.
O Problema com Outros Metais Nobres
Outros metais inertes, como o ouro, poderiam servir como condutor inerte. No entanto, o ouro é um catalisador significativamente mais pobre para a reação de hidrogênio em comparação com a platina. Embora um eletrodo de ouro não corroesse, a reação seria muito lenta para estabelecer um potencial de equilíbrio confiável e reproduzível, frustrando o propósito de um eletrodo "padrão".
Fazendo a Escolha Certa para o Seu Objetivo
Compreender a dupla função da platina é fundamental para apreender os princípios fundamentais da eletroquímica e dos padrões de referência.
- Se o seu foco principal é na cinética da reação: Lembre-se de que o principal objetivo da platina é atuar como um catalisador heterogêneo, diminuindo a energia de ativação para as reações de hidrogênio diretas e reversas.
- Se o seu foco principal é no projeto da célula: Lembre-se de que o material do eletrodo deve ser um condutor inerte que forneça uma interface física estável sem participar de quaisquer reações secundárias interferentes.
A seleção da platina é uma escolha de engenharia deliberada que permite que o eletrodo de hidrogênio sirva como o ponto zero universal para todas as medições eletroquímicas.
Tabela Resumo:
| Função | Por que a Platina é Ideal |
|---|---|
| Condutor Inerte | Resiste à corrosão em ácido, fornece uma interface física estável sem reações interferentes. |
| Catalisador Superior | Adsorve H₂ e H⁺, enfraquece as ligações H-H e diminui a energia de ativação para um equilíbrio rápido e reversível. |
| Área de Superfície Aumentada | A platinização (revestimento de negro de platina) maximiza os locais ativos para um desempenho eficiente. |
Precisa de equipamentos de laboratório confiáveis para análises eletroquímicas precisas? A KINTEK é especializada em equipamentos e consumíveis de laboratório de alta qualidade, garantindo que seu laboratório alcance resultados precisos e consistentes. Entre em contato com nossos especialistas hoje para encontrar a solução perfeita para suas necessidades de pesquisa!
Guia Visual
Produtos relacionados
- Eletrodo de Chapa de Platina para Aplicações Laboratoriais e Industriais
- Eletrodo de Referência Calomelano Cloreto de Prata Sulfato de Mercúrio para Uso Laboratorial
- Eletrodo de Disco de Platina Rotativo para Aplicações Eletroquímicas
- Eletrodo Auxiliar de Platina para Uso Laboratorial
- Eletrodo de Disco de Ouro
As pessoas também perguntam
- Que precauções devem ser tomadas ao usar um eletrodo de folha de platina? Garanta Dados Eletroquímicos Precisos e Reprodutíveis
- Quais são as especificações disponíveis para eletrodos de folha de platina? Encontre o Ajuste Perfeito para Suas Necessidades Eletroquímicas
- Qual é a vida útil esperada de um eletrodo de folha de platina? Maximize a Vida Útil do Seu Eletrodo
- Como deve ser pré-tratado um eletrodo de chapa de platina antes do uso? Garanta Medições Eletroquímicas Precisas
- Quais são as características de desempenho dos eletrodos de folha de platina? Desbloqueie um Desempenho Eletroquímico Superior



















