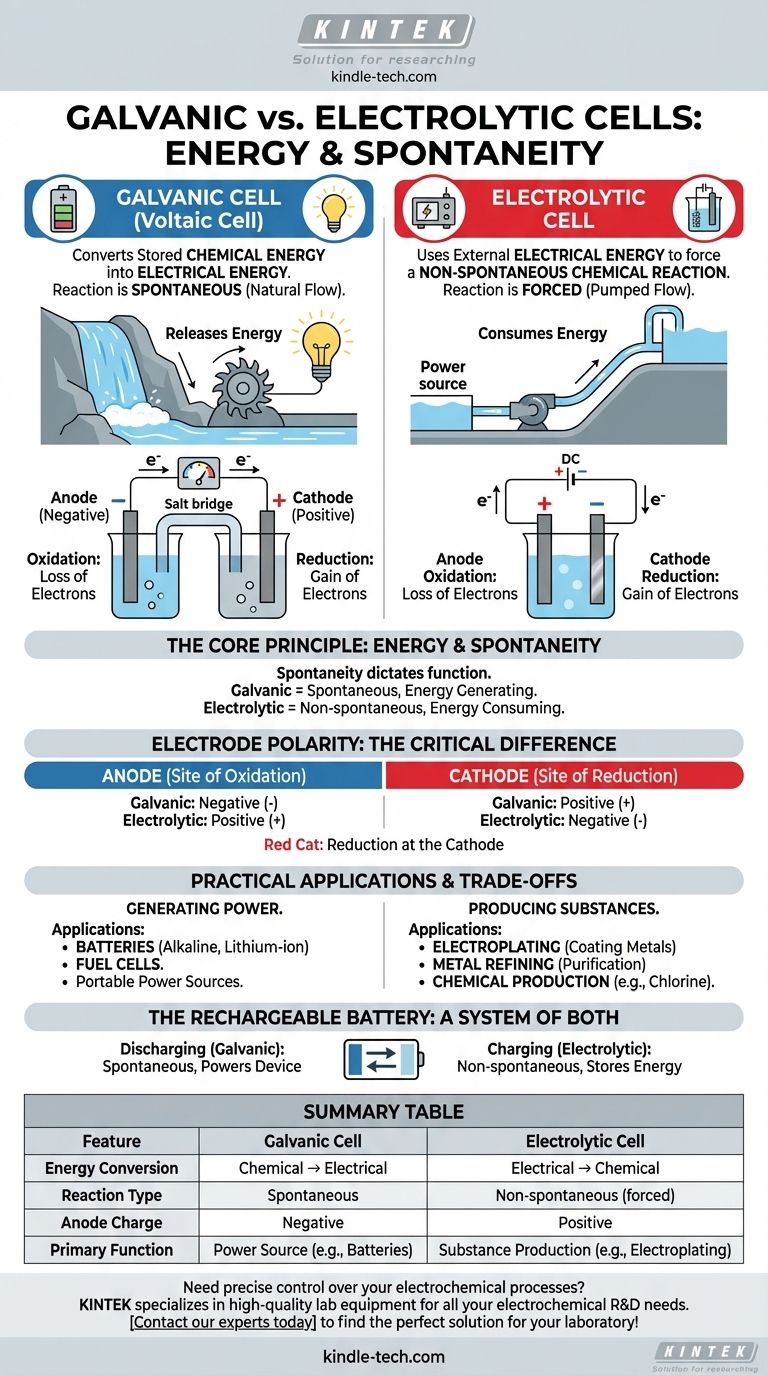
Em sua essência, a diferença entre uma célula galvânica e uma célula eletrolítica é a direção da conversão de energia. Uma célula galvânica (ou voltaica) converte energia química armazenada em energia elétrica através de uma reação espontânea, como uma bateria alimentando um dispositivo. Em contraste, uma célula eletrolítica usa energia elétrica externa para forçar a ocorrência de uma reação química não espontânea, como na galvanoplastia.
A distinção fundamental reside na espontaneidade. As células galvânicas aproveitam uma reação química que ocorre por si mesma, liberando energia como eletricidade. As células eletrolíticas usam eletricidade para forçar uma reação química que de outra forma não aconteceria.

O Princípio Central: Energia e Espontaneidade
O comportamento de qualquer célula eletroquímica é governado pelo fato de sua reação redox interna ser espontânea ou não espontânea. Este único princípio dita sua função e estrutura.
Células Galvânicas: Gerando Energia
Em uma célula galvânica, a reação química é espontânea. Isso significa que os reagentes têm maior energia potencial do que os produtos, e a reação prossegue naturalmente, liberando energia.
Essa energia liberada impulsiona elétrons através de um circuito externo, criando uma corrente elétrica. Pense nisso como uma cachoeira: a água flui naturalmente para baixo, e podemos colocar uma turbina em seu caminho para gerar eletricidade.
Células Eletrolíticas: Consumindo Energia
Em uma célula eletrolítica, a reação química desejada é não espontânea. Os produtos estão em um estado de energia mais elevado do que os reagentes, então a reação não acontecerá por si mesma.
Para que ocorra, devemos fornecer energia de uma fonte de alimentação externa (como uma bateria ou fonte de energia). Essa voltagem externa força os elétrons a se moverem contra sua direção natural, impulsionando a reação. Isso é como usar uma bomba para mover água para cima.
Como Este Princípio Define os Componentes da Célula
Embora as definições fundamentais do ânodo e do cátodo permaneçam as mesmas, sua carga (polaridade) é invertida entre os dois tipos de células. Este é um ponto comum de confusão, mas é uma consequência direta da espontaneidade.
O Ânodo: Sempre o Local da Oxidação
Em ambos os tipos de células, o ânodo é definido como o eletrodo onde ocorre a oxidação (a perda de elétrons).
O Cátodo: Sempre o Local da Redução
Da mesma forma, em ambos os tipos de células, o cátodo é o eletrodo onde ocorre a redução (o ganho de elétrons). Uma mnemônica simples é "Red Cat" (Redução no Cátodo).
A Diferença Crítica: Polaridade do Eletrodo
Em uma célula galvânica, a oxidação espontânea no ânodo libera um fluxo de elétrons. Esse acúmulo de carga negativa torna o ânodo negativo e o cátodo, que atrai os elétrons, positivo.
Em uma célula eletrolítica, uma fonte de energia externa é usada. Seu terminal positivo é conectado ao ânodo, onde ele puxa à força os elétrons das espécies químicas, causando a oxidação. Portanto, o ânodo é positivo e o cátodo é negativo.
Aplicações Práticas e Compromissos
A diferença entre gerar e consumir energia leva a aplicações no mundo real completamente diferentes para esses dois tipos de células.
Células Galvânicas na Prática: Energia Portátil
As células galvânicas são projetadas para serem fontes de energia. Sua principal aplicação é em baterias, desde baterias alcalinas de uso único até células de íon-lítio recarregáveis em seu telefone e carro.
As células a combustível são outro tipo de célula galvânica, gerando eletricidade continuamente enquanto o combustível (como hidrogênio) é fornecido.
Células Eletrolíticas na Prática: Fabricação e Refino
As células eletrolíticas são cavalos de batalha industriais usados para produzir materiais. As principais aplicações incluem galvanoplastia (revestir um objeto com uma fina camada de metal) e a purificação de metais como cobre e alumínio.
Elas também são essenciais para a produção de produtos químicos industriais importantes, como gás cloro e hidróxido de sódio a partir de água salgada (salmoura).
A Bateria Recarregável: Um Sistema de Ambos
Uma bateria recarregável é a ilustração perfeita de ambos os princípios. Quando está alimentando seu dispositivo, ela atua como uma célula galvânica, executando uma reação espontânea. Quando você a conecta para carregar, uma fonte de energia externa inverte o processo, transformando-a em uma célula eletrolítica para impulsionar uma reação não espontânea e restaurar os reagentes iniciais.
Fazendo a Escolha Certa para o Seu Objetivo
Sua compreensão de qual célula considerar depende inteiramente se você precisa produzir energia ou produzir uma substância.
- Se seu foco principal é gerar energia a partir de uma reação química: Você está trabalhando com uma célula galvânica, onde um processo espontâneo cria uma corrente elétrica.
- Se seu foco principal é criar uma substância usando eletricidade: Você está usando uma célula eletrolítica, onde uma voltagem externa impulsiona uma mudança química não espontânea.
- Se seu foco principal é armazenar e reutilizar energia elétrica: Você está lidando com um sistema recarregável que alterna entre ser uma célula eletrolítica (carregando) e uma célula galvânica (descarregando).
Em última análise, esses dois tipos de células são dois lados da mesma moeda eletroquímica, definidos pela direção do fluxo de energia.
Tabela Resumo:
| Característica | Célula Galvânica | Célula Eletrolítica |
|---|---|---|
| Conversão de Energia | Química → Elétrica | Elétrica → Química |
| Tipo de Reação | Espontânea | Não espontânea (forçada) |
| Carga do Ânodo | Negativa | Positiva |
| Função Primária | Fonte de Energia (ex: Baterias) | Produção de Substâncias (ex: Galvanoplastia) |
Precisa de controle preciso sobre seus processos eletroquímicos? O equipamento de laboratório certo é crucial para resultados precisos, seja você desenvolvendo novos materiais para baterias ou refinando técnicas de galvanoplastia. A KINTEK é especializada em equipamentos e consumíveis de laboratório de alta qualidade para todas as suas necessidades de pesquisa e desenvolvimento eletroquímico. Entre em contato com nossos especialistas hoje para encontrar a solução perfeita para o seu laboratório!
Guia Visual
Produtos relacionados
- Célula Eletrolítica Eletroquímica para Avaliação de Revestimentos
- Célula Eletroquímica Eletrolítica com Cinco Portas
- Célula Eletrolítica Eletroquímica Óptica de Dupla Camada Tipo H com Banho de Água
- Célula de Gás de Eletrólise Eletroquímica Eletrolítica Célula de Reação de Fluxo Líquido
- Banho de Água de Célula Eletroquímica Eletrolítica Multifuncional Camada Única Dupla Camada
As pessoas também perguntam
- Célula eletroquímica também é conhecida como célula eletrolítica? Entenda a Diferença Chave na Conversão de Energia
- Qual é a faixa de temperatura aplicável para a célula eletrolítica tipo H e como ela é controlada?
- Qual é a função de um agitador mecânico no aprimoramento da remoção de COT? Aumento da Oxidação no Tratamento de Efluentes de Farinha de Peixe
- Quais etapas devem ser tomadas antes de usar uma célula eletrolítica de banho-maria de dupla camada? Garanta resultados eletroquímicos precisos
- Qual é a função de uma célula eletrolítica de três eletrodos? Aumentar a precisão da EIS para a avaliação de revestimentos de poliéster
- Qual é o papel de uma célula eletrolítica encamisada a água nas medições de corrosão eletroquímica com temperatura variável?
- Como o corpo de uma célula eletrolítica deve ser mantido para longevidade? Estenda a vida útil do seu equipamento
- Qual é a função de uma célula de Devanathan-Stachurski? Caracterização da Difusão de Hidrogênio em Martensita







