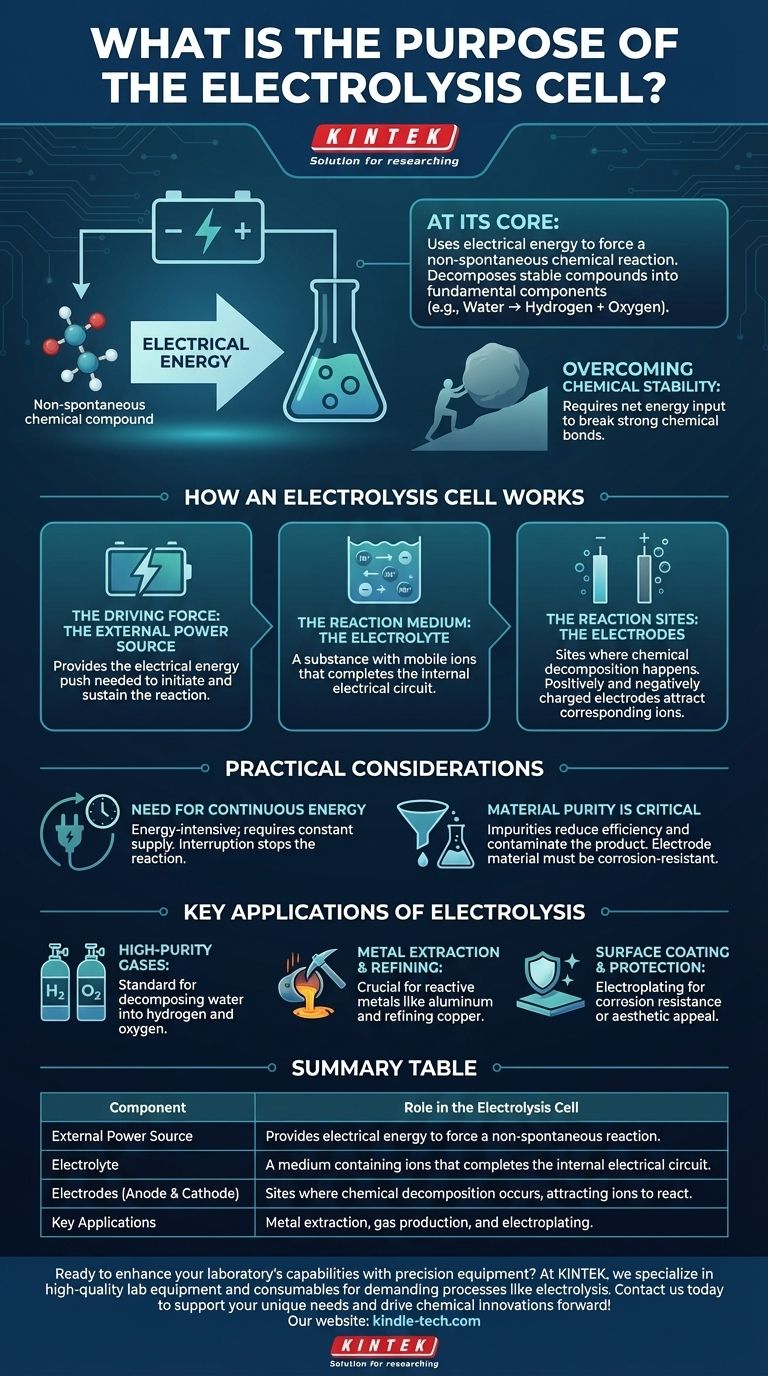
Em sua essência, o propósito de uma célula eletrolítica é usar energia elétrica para forçar uma reação química que não ocorreria por conta própria. Este processo, conhecido como eletrólise, permite-nos decompor compostos químicos estáveis em seus componentes mais fundamentais, como a quebra da água em hidrogênio e oxigênio.
Embora muitas reações químicas liberem energia, alguns dos processos industriais mais importantes exigem uma entrada de energia para ocorrer. A célula eletrolítica é a ferramenta fundamental projetada para fornecer essa energia, usando eletricidade para impulsionar reações não espontâneas e criar produtos químicos valiosos.

Como Funciona uma Célula Eletrolítica
Uma célula eletrolítica é um sistema com três componentes críticos que trabalham juntos para alcançar uma mudança química específica. Entender cada parte esclarece todo o processo.
A Força Motriz: A Fonte de Energia Externa
Uma fonte de energia externa, como uma bateria, fornece a energia elétrica necessária. Essa energia atua como o "impulso" necessário para iniciar e sustentar uma reação química que não é energeticamente favorável. Sem essa voltagem externa, a decomposição não ocorreria.
O Meio de Reação: O Eletrólito
O eletrólito é o meio que permite o fluxo de partículas carregadas (íons). Não é simplesmente um líquido; é uma substância, tipicamente uma solução de sais dissolvidos em água ou um sal fundido, que contém íons móveis. Este movimento de íons entre os eletrodos é o que completa o circuito elétrico dentro da célula.
Os Locais de Reação: Os Eletrodos
Dois eletrodos (um ânodo e um cátodo) são imersos no eletrólito. Estes são os locais físicos onde a decomposição química realmente acontece. Quando a fonte de energia externa é aplicada, um eletrodo torna-se carregado positivamente e o outro negativamente, atraindo os íons correspondentes do eletrólito e forçando-os a reagir.
O Objetivo Fundamental: Forçar uma Reação Não Espontânea
Todo o propósito da célula é superar a estabilidade natural de um composto. Esta é a principal diferença entre uma célula eletrolítica e uma célula galvânica (como uma bateria padrão), que libera energia de uma reação espontânea.
Superando a Estabilidade Química
Uma reação não espontânea é aquela que requer uma entrada líquida de energia para prosseguir. Pense nisso como empurrar uma pedra montanha acima — ela não acontecerá sozinha. A energia elétrica fornecida à célula eletrolítica fornece a força necessária para empurrar essa "pedra química" montanha acima, quebrando fortes ligações químicas.
O Significado de Eletrólise
O próprio nome explica a função. Vem de "eletro," referindo-se à eletricidade, e da palavra grega "lise," que significa quebrar ou decompor. A célula usa eletricidade para decompor um composto.
Entendendo as Considerações Práticas
Embora poderosa, a eletrólise não está isenta de seus requisitos e limitações. Sua aplicação é uma escolha de engenharia deliberada baseada em trocas específicas.
A Necessidade de Energia Contínua
A eletrólise é um processo intensivo em energia. Requer um fornecimento constante e muitas vezes substancial de eletricidade para funcionar. Se a energia for interrompida, a reação para imediatamente. Esse custo de energia é um fator primário na viabilidade econômica da eletrólise industrial.
A Pureza do Material é Crítica
A pureza do eletrólito é crucial. Impurezas podem levar a reações colaterais indesejadas, reduzindo a eficiência do processo principal e contaminando o produto final. A escolha do material do eletrodo também é vital, pois deve resistir ao ambiente corrosivo e não interferir na reação desejada.
Aplicações Chave da Eletrólise
A aplicação correta depende inteiramente do seu objetivo final. A versatilidade da eletrólise a torna um pilar da química e da indústria modernas.
- Se o seu foco principal é a produção de gases de alta pureza: A eletrólise é o método padrão para decompor a água (H₂O) em hidrogênio e oxigênio excepcionalmente puros.
- Se o seu foco principal é a extração e refino de metais: O processo é indispensável para produzir metais altamente reativos como o alumínio a partir de seu minério (bauxita) ou refinar o cobre a alta pureza.
- Se o seu foco principal é o revestimento e proteção de superfícies: Um processo eletrolítico semelhante, conhecido como galvanoplastia, é usado para depositar uma fina camada de um metal (como cromo ou ouro) sobre outro para resistência à corrosão ou apelo estético.
Em última análise, a célula eletrolítica é uma ferramenta fundamental para converter energia elétrica em mudança química valiosa, permitindo-nos criar substâncias que a natureza não produziria por conta própria.
Tabela de Resumo:
| Componente | Função na Célula Eletrolítica |
|---|---|
| Fonte de Energia Externa | Fornece energia elétrica para forçar uma reação não espontânea. |
| Eletrólito | Um meio contendo íons que completa o circuito elétrico interno. |
| Eletrodos (Ânodo e Cátodo) | Locais onde ocorre a decomposição química, atraindo íons para reagir. |
| Aplicações Chave | Extração de metais (ex: alumínio), produção de gás (ex: hidrogênio) e galvanoplastia. |
Pronto para aprimorar as capacidades do seu laboratório com equipamentos de precisão? Na KINTEK, especializamo-nos em fornecer equipamentos de laboratório e consumíveis de alta qualidade adaptados para processos exigentes como a eletrólise. Se você está refinando metais, produzindo gases de alta pureza ou realizando galvanoplastia, nossas ferramentas confiáveis garantem eficiência e precisão. Entre em contato conosco hoje para descobrir como a KINTEK pode apoiar as necessidades exclusivas do seu laboratório e impulsionar suas inovações químicas!
Guia Visual
Produtos relacionados
- Célula Eletroquímica Eletrolítica de Quartzo para Experimentos Eletroquímicos
- Célula Eletrolítica Eletroquímica Óptica de Dupla Camada Tipo H com Banho de Água
- Célula de Gás de Eletrólise Eletroquímica Eletrolítica Célula de Reação de Fluxo Líquido
- Célula de Fluxo de Redução de CO2 Personalizável para Pesquisa em NRR, ORR e CO2RR
- Caixa de Bateria Li-Ar para Aplicações de Laboratório de Baterias
As pessoas também perguntam
- Que materiais são usados para construir a célula eletrolítica de quartzo puro? Um Guia para Pureza e Desempenho
- Quais são os volumes e dimensões disponíveis para a célula eletrolítica totalmente de quartzo? Encontre o Ajuste Perfeito para o Seu Laboratório
- Quais são as etapas necessárias para preparar uma célula eletrolítica totalmente de quartzo antes de um experimento? Garanta precisão e segurança
- Como uma célula eletrolítica totalmente de quartzo e seus componentes devem ser mantidos para uso a longo prazo? Um Guia para Maximizar a Vida Útil do Equipamento
- Que precauções devem ser tomadas ao manusear e usar uma célula eletrolítica de quartzo puro? Garanta um Desempenho Seguro, Preciso e Durável



















