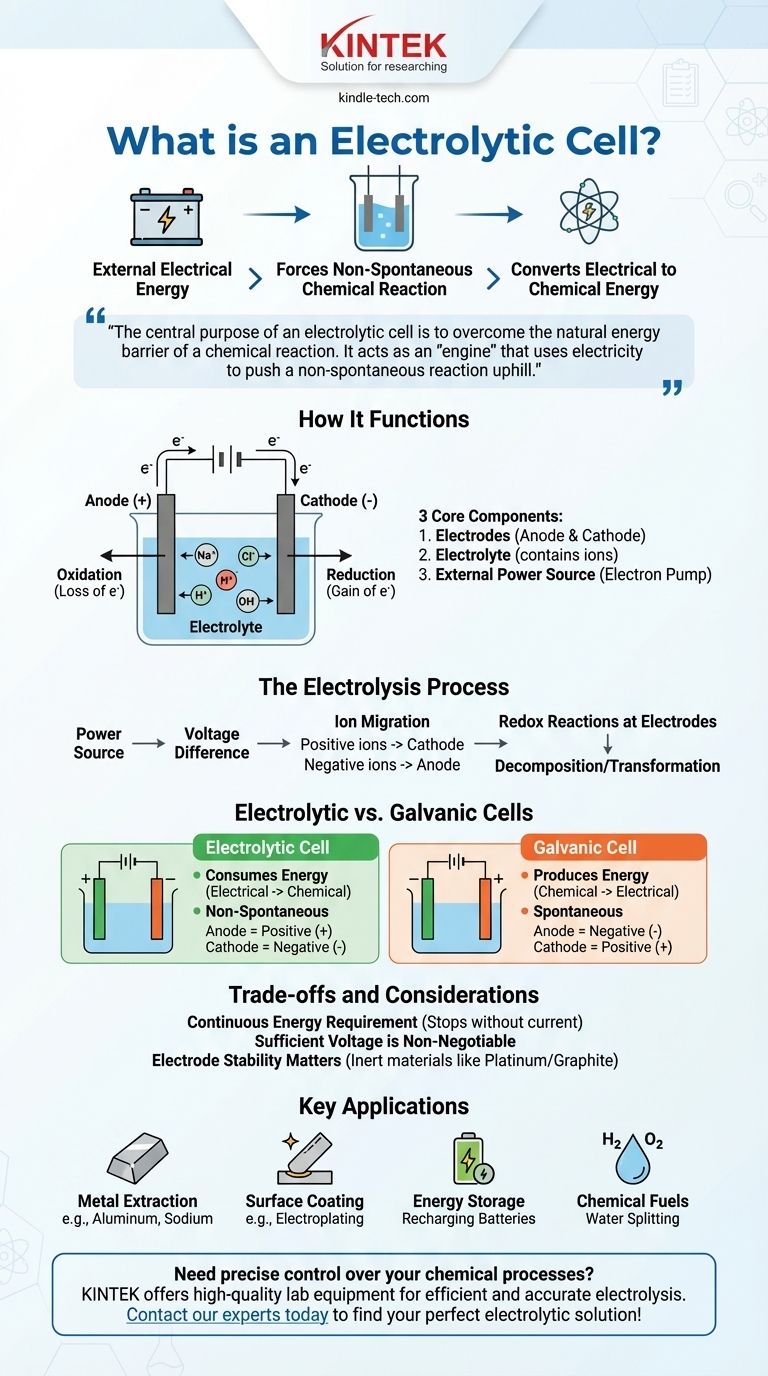
Em essência, uma célula eletrolítica é um dispositivo que usa energia elétrica de uma fonte externa, como uma bateria, para forçar uma reação química que não ocorreria por si mesma. Este processo, conhecido como eletrólise, converte energia elétrica em energia química armazenada, decompondo compostos como água ou sais fundidos.
O propósito central de uma célula eletrolítica é superar a barreira de energia natural de uma reação química. Ela atua como um "motor" que usa eletricidade para impulsionar uma reação não espontânea "morro acima", realizando tarefas como separar elementos ou carregar uma bateria.

Como Funciona uma Célula Eletrolítica
Para entender uma célula eletrolítica, devemos analisar suas partes essenciais e o processo que elas possibilitam. Todo o sistema é projetado para controlar o fluxo de elétrons e íons para impulsionar uma mudança química específica.
Os Três Componentes Principais
Uma célula eletrolítica é construída a partir de três partes primárias.
-
Eletrodos (Ânodo e Cátodo): São dois condutores metálicos ou eletrônicos que servem como locais para a reação química. O ânodo é o eletrodo positivo onde ocorre a oxidação (perda de elétrons), e o cátodo é o eletrodo negativo onde ocorre a redução (ganho de elétrons).
-
Eletrólito: É uma substância, tipicamente uma solução líquida ou um sal fundido, que contém íons de movimento livre. O eletrólito permite que a carga flua entre os dois eletrodos, completando o circuito elétrico.
-
Fonte de Alimentação Externa: Este é um componente crucial, como uma bateria ou fonte de alimentação CC. Ele atua como uma "bomba de elétrons", puxando elétrons do ânodo e empurrando-os para o cátodo.
O Processo de Eletrólise
A fonte de alimentação cria uma diferença de voltagem entre os eletrodos.
Isso força os íons no eletrólito a migrarem. Íons carregados positivamente movem-se em direção ao cátodo negativo, e íons carregados negativamente movem-se em direção ao ânodo positivo.
Nos eletrodos, ocorrem reações redox (transferência de carga). No ânodo, as substâncias perdem elétrons, e no cátodo, as substâncias ganham elétrons, resultando na decomposição ou transformação dos componentes do eletrólito.
A Distinção Crítica: Células Eletrolíticas vs. Galvânicas
Um ponto comum de confusão é a diferença entre uma célula eletrolítica e sua contraparte, a célula galvânica (ou voltaica), que é o que tipicamente consideramos uma bateria padrão.
Conversão de Energia
Uma célula eletrolítica consome energia. Ela converte energia elétrica em energia química.
Uma célula galvânica produz energia. Ela converte energia química armazenada em energia elétrica.
Espontaneidade da Reação
A reação em uma célula eletrolítica é não espontânea. Ela requer uma entrada de energia externa para ocorrer.
A reação em uma célula galvânica é espontânea. Ela ocorre naturalmente, liberando energia no processo.
Polaridade do Eletrodo
Em uma célula eletrolítica, o ânodo é positivo e o cátodo é negativo. Isso ocorre porque a fonte de alimentação externa dita a carga.
Em uma célula galvânica, o ânodo é negativo e o cátodo é positivo. A própria reação química espontânea determina a carga.
Compreendendo as Vantagens e Considerações
Embora poderosas, as células eletrolíticas operam sob restrições específicas que são importantes de reconhecer.
Uma Exigência Contínua de Energia
A característica principal de uma célula eletrolítica é sua dependência de uma fonte de alimentação externa. O processo de eletrólise para no momento em que a corrente elétrica é removida.
Voltagem Suficiente é Inegociável
A voltagem externa aplicada deve ser alta o suficiente para superar a resistência natural da reação não espontânea. Se a voltagem for muito baixa, nenhuma mudança química ocorrerá.
A Estabilidade do Eletrodo Importa
Os próprios eletrodos devem ser escolhidos cuidadosamente. Em muitos processos, eles são feitos de materiais inertes como platina ou grafite que facilitam a reação sem serem consumidos. Em outras aplicações, o material do eletrodo é intencionalmente escolhido para participar da reação, como visto em alguns tipos de purificação.
Principais Aplicações das Células Eletrolíticas
A capacidade de forçar reações químicas confere às células eletrolíticas um papel central na indústria e na tecnologia.
- Se o seu foco principal é a produção de elementos puros: A eletrólise é usada para extrair metais como o alumínio de seu minério (bauxita) ou para produzir sódio e gás cloro a partir de cloreto de sódio fundido.
- Se o seu foco principal é o revestimento de superfícies: O processo de eletrodeposição usa uma célula eletrolítica para depositar uma fina camada de um metal (como cromo ou ouro) sobre outro para proteção ou decoração.
- Se o seu foco principal é o armazenamento de energia: Recarregar uma bateria envolve fazê-la funcionar como uma célula eletrolítica. O carregador externo força os íons de volta ao seu estado original, armazenando energia para uso posterior.
- Se o seu foco principal é a criação de combustíveis químicos: As células eletrolíticas podem dividir a água (H₂O) em gás hidrogênio e gás oxigênio, com o hidrogênio servindo como uma fonte de combustível limpa.
Ao aplicar energia elétrica com precisão, uma célula eletrolítica nos dá controle direto sobre as transformações químicas.
Tabela Resumo:
| Característica | Célula Eletrolítica | Célula Galvânica (Bateria) |
|---|---|---|
| Conversão de Energia | Converte energia elétrica em energia química | Converte energia química em energia elétrica |
| Tipo de Reação | Não espontânea (requer energia externa) | Espontânea (ocorre naturalmente) |
| Carga do Ânodo | Positiva | Negativa |
| Função Principal | Impulsionar reações químicas desejadas (ex: eletrodeposição) | Gerar eletricidade |
Precisa de controle preciso sobre seus processos químicos? Os equipamentos de laboratório de alta qualidade da KINTEK, incluindo fontes de alimentação confiáveis e eletrodos duráveis, são essenciais para uma eletrólise eficiente e precisa. Seja sua aplicação eletrodeposição, purificação de metais ou pesquisa de armazenamento de energia, nossos consumíveis e instrumentos são projetados para desempenho superior. Entre em contato com nossos especialistas hoje para encontrar a solução eletrolítica perfeita para as necessidades do seu laboratório!
Guia Visual
Produtos relacionados
- Célula Eletroquímica Eletrolítica com Cinco Portas
- Célula Eletrolítica Tipo H Tripla Eletroquímica
- Célula Eletrolítica Eletroquímica para Avaliação de Revestimentos
- Célula Eletrolítica Eletroquímica Óptica de Dupla Camada Tipo H com Banho de Água
- Célula Eletrolítica de Banho de Água de Cinco Portas de Camada Dupla
As pessoas também perguntam
- Quais são os procedimentos corretos de armazenamento para a célula eletrolítica multifuncional? Proteja seu Investimento e Garanta a Precisão dos Dados
- Que precaução geral deve ser tomada ao manusear a célula eletrolítica? Garanta Resultados de Laboratório Seguros e Precisos
- Como o corpo de uma célula eletrolítica deve ser mantido para longevidade? Estenda a vida útil do seu equipamento
- De que material é feita a célula eletrolítica de banho-maria de cinco portas? Vidro Borossilicato Alto e PTFE Explicados
- Como deve ser limpa a célula eletrolítica de banho-maria de cinco portas para manutenção? Um Guia Passo a Passo para Resultados Confiáveis



















