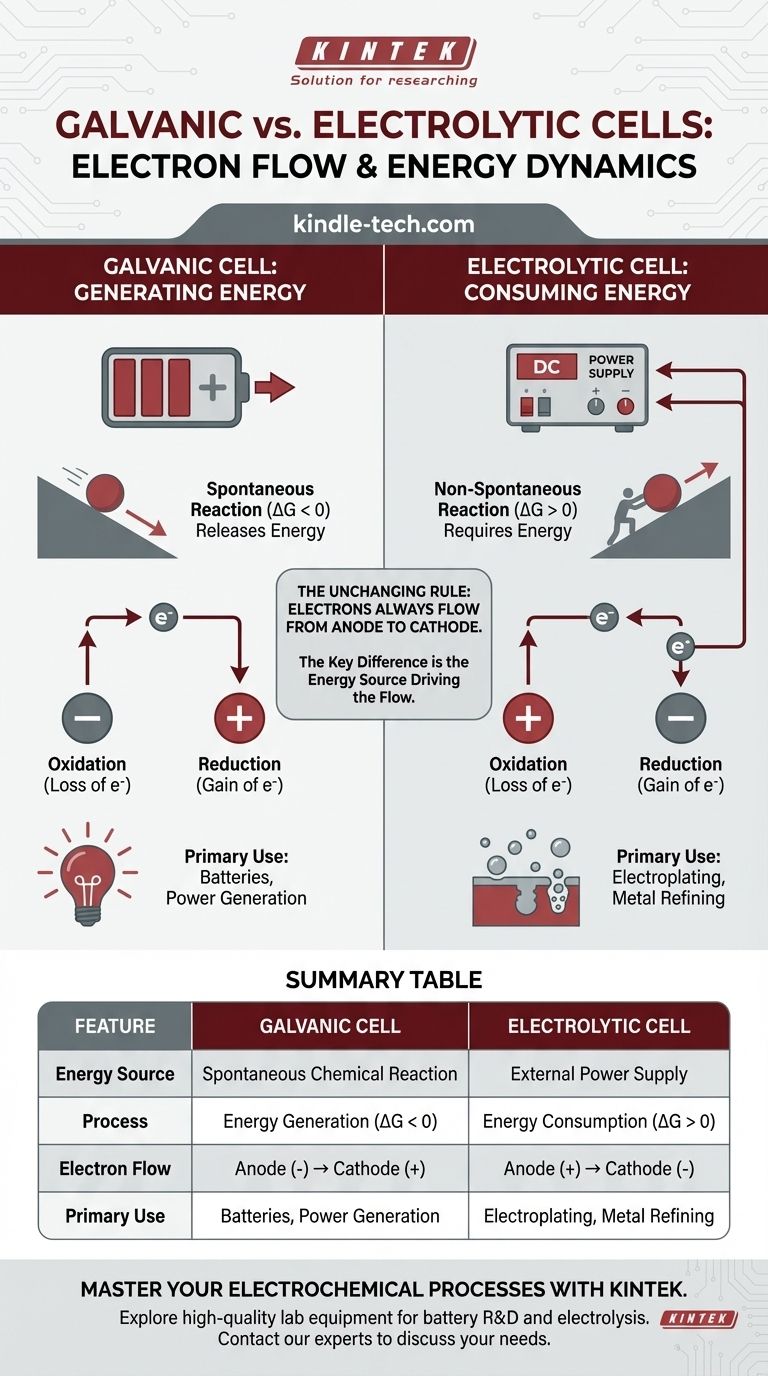
Em qualquer célula eletroquímica, o fluxo de elétrons no circuito externo é sempre do ânodo para o cátodo. A distinção crítica reside no porquê eles fluem. Em uma célula galvânica, uma reação química espontânea gera energia e empurra os elétrons. Em uma célula eletrolítica, uma fonte de energia externa fornece a energia para forçar o fluxo de elétrons e impulsionar uma reação não espontânea.
A diferença fundamental não é a direção do fluxo de elétrons em relação à oxidação e redução, mas a fonte de energia que impulsiona o processo. Uma célula galvânica converte energia química armazenada em energia elétrica, enquanto uma célula eletrolítica usa energia elétrica externa para forçar uma mudança química.

O Princípio Central: Reações Espontâneas vs. Não Espontâneas
Para entender o fluxo de elétrons, você deve primeiro entender a dinâmica de energia da célula. Todo o sistema é regido se a reação química ocorre por conta própria ou se precisa ser forçada.
Células Galvânicas: Gerando Energia
Uma célula galvânica (também chamada de célula voltaica) aproveita uma reação química espontânea. Pense nisso como uma bola rolando ladeira abaixo — o processo libera energia naturalmente.
Essa reação espontânea tem uma energia livre de Gibbs negativa (ΔG < 0). Essa liberação de energia química é convertida diretamente em energia elétrica, empurrando os elétrons do ânodo, através do circuito externo, e para o cátodo.
As células galvânicas são a base para todas as baterias convencionais.
Células Eletrolíticas: Consumindo Energia
Uma célula eletrolítica é usada para impulsionar uma reação química não espontânea. Isso é como empurrar uma bola ladeira acima — requer uma entrada constante de energia externa para acontecer.
Essa reação tem uma energia livre de Gibbs positiva (ΔG > 0). Uma fonte de energia externa, como uma bateria ou fonte de alimentação, atua como uma "bomba de elétrons". Ela força os elétrons para o cátodo e os retira do ânodo, impulsionando uma reação que não ocorreria por conta própria.
Desvendando o Fluxo de Elétrons e a Polaridade dos Eletrodos
A confusão em torno do fluxo de elétrons geralmente decorre da polaridade variável dos eletrodos. Embora os papéis de ânodo e cátodo sejam fixos, suas cargas não são.
A Regra Invariável: Ânodo para Cátodo
Por definição, o local da oxidação (perda de elétrons) é sempre o ânodo, e o local da redução (ganho de elétrons) é sempre o cátodo.
Como os elétrons são perdidos no ânodo e ganhos no cátodo, os elétrons no fio externo sempre fluem do ânodo para o cátodo. Esta é uma constante universal para ambos os tipos de células.
A Diferença Crítica: Carga do Eletrodo
A polaridade (a carga positiva ou negativa) dos eletrodos se inverte entre os dois tipos de células, o que é a fonte da maior parte da confusão.
Em uma célula galvânica, o ânodo é o local da oxidação espontânea que libera elétrons. Esse acúmulo de carga negativa torna o ânodo o terminal negativo (-). O cátodo, que consome elétrons, torna-se o terminal positivo (+).
Em uma célula eletrolítica, a fonte de energia externa dita a polaridade. Ela conecta seu terminal negativo ao cátodo da célula para forçar os elétrons sobre ele e impulsionar a redução. Ela conecta seu terminal positivo ao ânodo da célula para retirar os elétrons e impulsionar a oxidação.
- Célula Galvânica: Ânodo (-) para Cátodo (+)
- Célula Eletrolítica: Ânodo (+) para Cátodo (-)
Compreendendo as Aplicações Práticas
A diferença fundamental na conversão de energia determina como essas células são usadas. Uma produz energia e a outra a consome para produzir materiais valiosos.
Células Galvânicas: Energia Sob Demanda
O principal benefício de uma célula galvânica é sua capacidade de atuar como uma fonte portátil de energia elétrica.
Elas são a base para baterias, desde pilhas AA simples até baterias de carro. Sua principal limitação é que os reagentes químicos são eventualmente consumidos, fazendo com que a tensão caia e a bateria descarregue.
Células Eletrolíticas: Forçando a Mudança Química
O objetivo de uma célula eletrolítica é usar eletricidade para criar um produto químico.
Este processo, conhecido como eletrólise, é essencial para aplicações industriais como refino de metais (por exemplo, produção de alumínio puro), revestimento de superfícies com uma camada protetora de metal e separação da água em hidrogênio e oxigênio. Sua desvantagem é a necessidade de um suprimento contínuo e muitas vezes caro de energia elétrica.
Como Aplicar Isso ao Seu Objetivo
Sua abordagem depende inteiramente se você precisa gerar eletricidade ou impulsionar uma reação química.
- Se seu foco principal é gerar energia ou criar uma bateria: Você está trabalhando com uma célula galvânica, onde uma reação espontânea produz uma corrente elétrica.
- Se seu foco principal é purificar um metal, revestir uma superfície ou separar um composto: Você precisa de uma célula eletrolítica, que usa energia externa para impulsionar uma reação não espontânea.
- Se seu foco principal é entender o princípio central: Lembre-se de que a oxidação está sempre no ânodo e a redução no cátodo; a diferença fundamental é se a reação é espontânea (galvânica) ou forçada (eletrolítica).
Compreender essa distinção entre liberação espontânea de energia e entrada forçada de energia é a chave para dominar as células eletroquímicas.
Tabela de Resumo:
| Característica | Célula Galvânica | Célula Eletrolítica |
|---|---|---|
| Fonte de Energia | Reação Química Espontânea | Fonte de Alimentação Externa |
| Processo | Geração de Energia (ΔG < 0) | Consumo de Energia (ΔG > 0) |
| Fluxo de Elétrons | Ânodo (-) → Cátodo (+) | Ânodo (+) → Cátodo (-) |
| Uso Principal | Baterias, Geração de Energia | Eletrodeposição, Refino de Metais |
Domine Seus Processos Eletroquímicos com a KINTEK
Quer você esteja desenvolvendo novas tecnologias de baterias ou refinando materiais por eletrólise, ter o equipamento de laboratório certo é crucial para resultados precisos e confiáveis. A KINTEK é especializada em equipamentos e consumíveis de laboratório de alta qualidade, fornecendo as ferramentas exatas de que você precisa para toda a sua pesquisa e desenvolvimento eletroquímico.
Deixe-nos ajudá-lo a equipar seu laboratório para o sucesso. Entre em contato com nossos especialistas hoje para discutir suas necessidades específicas e descobrir como a KINTEK pode apoiar seu trabalho inovador.
Guia Visual
Produtos relacionados
- Célula Eletrolítica Eletroquímica Óptica de Dupla Camada Tipo H com Banho de Água
- Célula Eletrolítica Eletroquímica para Avaliação de Revestimentos
- Célula Eletroquímica Eletrolítica de Quartzo para Experimentos Eletroquímicos
- Célula Eletrolítica Tipo H Tripla Eletroquímica
- Célula Eletrolítica de PTFE Célula Eletroquímica Resistente à Corrosão Selada e Não Selada
As pessoas também perguntam
- Quais características ópticas a célula eletrolítica tipo H possui? Janelas de quartzo de precisão para fotoeletroquímica
- Qual é a estrutura de uma célula eletrolítica de membrana intercambiável tipo H? Um guia para separação eletroquímica precisa
- Qual é a estrutura geral da célula eletrolítica de banho-maria óptico de dupla camada tipo H? Design de Precisão para Experimentos Controlados
- Qual é o propósito da estrutura de dupla camada na célula eletrolítica tipo H? Alcançar Controle Térmico Preciso
- Quais são os volumes típicos e as configurações de abertura para uma célula eletrolítica de banho-maria de dupla camada? Otimize sua Configuração Eletroquímica



















