Embora sua pergunta mencione duas células eletrolíticas, a distinção central na eletroquímica é entre uma célula eletrolítica e uma célula galvânica (também conhecida como célula voltaica). Uma célula galvânica gera energia elétrica a partir de uma reação química espontânea, como uma bateria comum. Em contraste, uma célula eletrolítica usa uma fonte externa de energia elétrica para forçar a ocorrência de uma reação química não espontânea.
A diferença fundamental reside na conversão de energia. Uma célula galvânica converte energia química armazenada em energia elétrica, enquanto uma célula eletrolítica faz exatamente o oposto, convertendo energia elétrica em energia química para produzir substâncias desejadas.

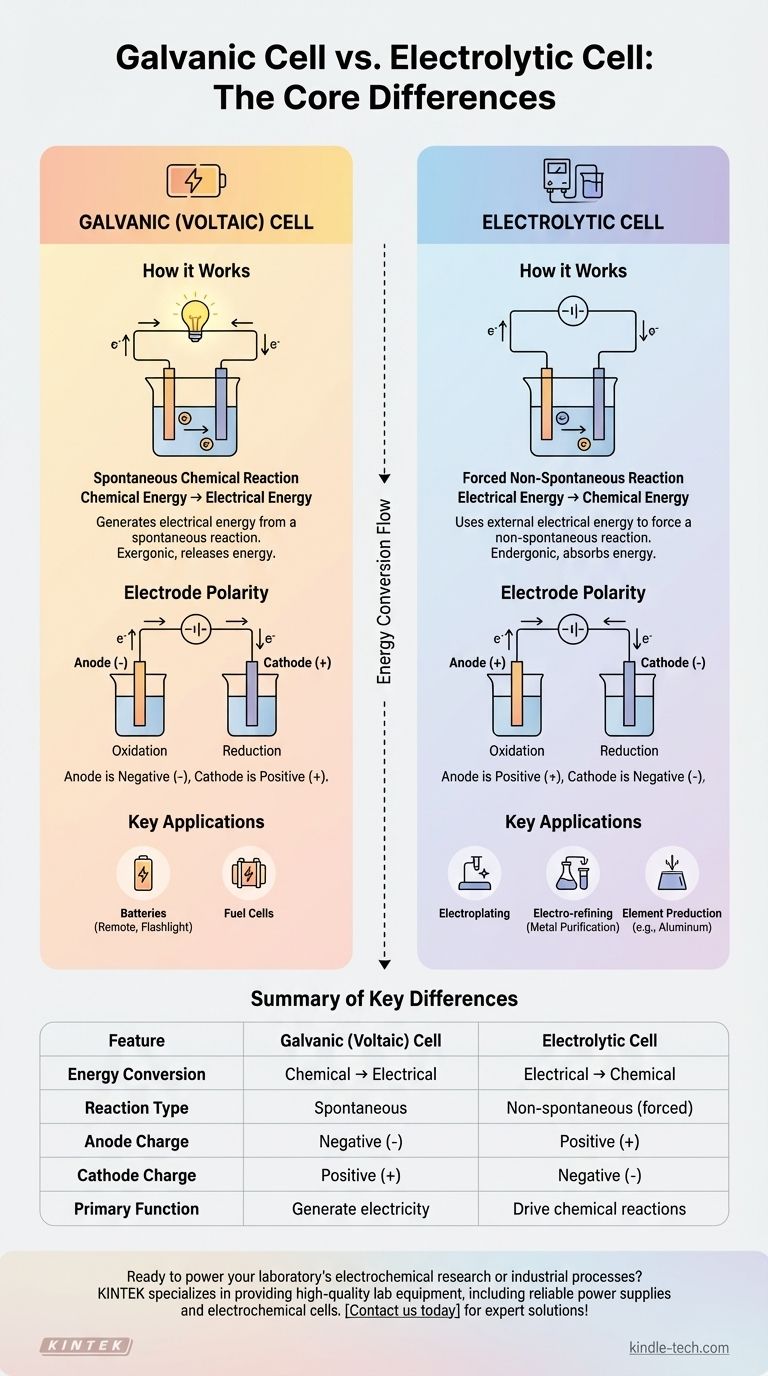
Como Funcionam as Células Galvânicas (Voltaicas)
Uma célula galvânica é um sistema autônomo que produz eletricidade. Pense em qualquer bateria padrão que você usa em um controle remoto ou lanterna.
Reações Químicas Espontâneas
O motor de uma célula galvânica é uma reação redox (redução-oxidação) espontânea. Isso significa que a reação química ocorre naturalmente sem qualquer entrada de energia externa, liberando energia no processo.
Conversão de Energia: Química para Elétrica
A energia liberada pela reação espontânea empurra elétrons através de um circuito externo, criando uma corrente elétrica. Ela transforma efetivamente a energia potencial química armazenada em energia elétrica utilizável.
Polaridade do Eletrodo
Em uma célula galvânica, o ânodo é o eletrodo negativo onde ocorre a oxidação, e o cátodo é o eletrodo positivo onde ocorre a redução. Os elétrons fluem do ânodo negativo para o cátodo positivo.
Como Funcionam as Células Eletrolíticas
Uma célula eletrolítica é usada para impulsionar mudanças químicas que não ocorreriam por conta própria. Este processo é conhecido como eletrólise.
Forçando Reações Não Espontâneas
Essas células são projetadas para forçar a ocorrência de uma reação não espontânea. Por exemplo, a água não se decompõe espontaneamente em hidrogênio e oxigênio; ela requer energia para ser forçada a se separar.
O Papel de uma Fonte de Energia Externa
Para impulsionar essa reação, uma célula eletrolítica deve ser conectada a uma fonte de energia externa, como uma bateria ou uma fonte de alimentação CC. Essa fonte fornece a energia necessária para superar a resistência natural da reação.
A Função do Eletrólito
A célula contém um eletrólito, que é tipicamente um sal fundido ou uma solução salina. Essa substância contém íons móveis que são atraídos para os eletrodos, permitindo que as reações químicas ocorram e completando o circuito elétrico.
Aplicações na Indústria
Este processo é fundamental para muitas aplicações industriais, incluindo eletrodeposição (revestimento de um objeto com uma fina camada de metal), eletro-refino para purificar metais como cobre e produção de elementos puros como alumínio a partir do minério de bauxita.
Compreendendo as Diferenças Fundamentais
Comparar essas duas células lado a lado revela sua natureza oposta. Elas são dois lados da mesma moeda eletroquímica.
Fluxo de Energia e Espontaneidade
Uma célula galvânica é exergônica, o que significa que libera energia de uma reação espontânea. Uma célula eletrolítica é endergônica, o que significa que absorve energia para impulsionar uma reação não espontânea.
Inversão da Polaridade do Eletrodo
Este é um ponto crítico de distinção. Embora a oxidação sempre ocorra no ânodo e a redução no cátodo, suas cargas são invertidas.
- Em uma célula galvânica: Ânodo é negativo (-), Cátodo é positivo (+).
- Em uma célula eletrolítica: Ânodo é positivo (+), Cátodo é negativo (-).
Essa inversão ocorre porque a fonte de energia externa em uma célula eletrolítica dita o fluxo de elétrons, anulando a tendência natural do sistema químico.
Fazendo a Escolha Certa para o Seu Objetivo
Entender qual célula usar depende inteiramente se o seu objetivo é gerar energia ou criar um produto químico.
- Se o seu foco principal é gerar energia a partir de um processo químico: Você está descrevendo uma célula galvânica (voltaica), que é o princípio por trás de todas as baterias.
- Se o seu foco principal é usar energia para criar uma substância: Você precisa de uma célula eletrolítica, que é a base para a eletrodeposição industrial, refino e produção de elementos.
- Se o seu foco principal é entender a eletroquímica básica: Lembre-se de que as células galvânicas liberam energia espontaneamente, enquanto as células eletrolíticas requerem energia para forçar uma reação.
Em última análise, a direção da conversão de energia é o fator mais importante que define e separa essas duas células eletroquímicas fundamentais.
Tabela de Resumo:
| Característica | Célula Galvânica (Voltaica) | Célula Eletrolítica |
|---|---|---|
| Conversão de Energia | Química → Elétrica | Elétrica → Química |
| Tipo de Reação | Espontânea | Não espontânea (forçada) |
| Carga do Ânodo | Negativa (-) | Positiva (+) |
| Carga do Cátodo | Positiva (+) | Negativa (-) |
| Função Principal | Gerar eletricidade (ex: baterias) | Impulsionar reações químicas (ex: eletrodeposição, refino) |
Pronto para impulsionar a pesquisa eletroquímica ou os processos industriais do seu laboratório? A KINTEK é especializada em fornecer equipamentos de laboratório e consumíveis de alta qualidade, incluindo fontes de alimentação confiáveis e células eletroquímicas adaptadas às suas necessidades específicas. Se você está desenvolvendo novas tecnologias de baterias ou otimizando sistemas de eletrodeposição, nossa experiência garante que você tenha as ferramentas certas para o sucesso. Entre em contato conosco hoje para discutir como podemos apoiar seus projetos com equipamentos de precisão e soluções especializadas!
Guia Visual
Produtos relacionados
- Célula Eletroquímica Eletrolítica com Cinco Portas
- Célula Eletrolítica Eletroquímica para Avaliação de Revestimentos
- Célula Eletrolítica Eletroquímica Óptica de Dupla Camada Tipo H com Banho de Água
- Célula Eletrolítica Tipo H Tripla Eletroquímica
- Célula Eletrolítica de Banho de Água de Cinco Portas de Camada Dupla
As pessoas também perguntam
- Por que o uso de recipientes de reação com capacidades de controle ambiental é essencial na mecanoquímica?
- Por que é importante controlar o ambiente experimental para a eletrólise? Garanta resultados precisos e reproduzíveis
- Quais são as funções primárias de uma estação de trabalho eletroquímica (Potenciostato)? Análise de Corrosão de Ligas de Titânio por Especialistas
- Qual é o procedimento correto pós-experimento para uma célula espectro-eletroquímica de camada fina? Um Guia Passo a Passo para Segurança Laboratorial e Precisão
- Qual é o propósito de usar um sistema de polimento e corrosão eletrolítica na análise da microestrutura de materiais candidatos para Reatores Rápidos Resfriados a Chumbo?
- Quais são as vantagens de usar uma célula eletrolítica de vidro de câmara dupla para avaliar o desempenho do ânodo de MFC?
- Por que uma célula eletroquímica de vidro com tampa de plexiglass é utilizada para ligas Zr2.5Nb? Garanta precisão em testes de corrosão
- Que tipos e tamanhos de eletrodos são tipicamente configurados com uma célula espectroeletroquímica de camada fina? Configuração Padrão para Análise Precisa



















