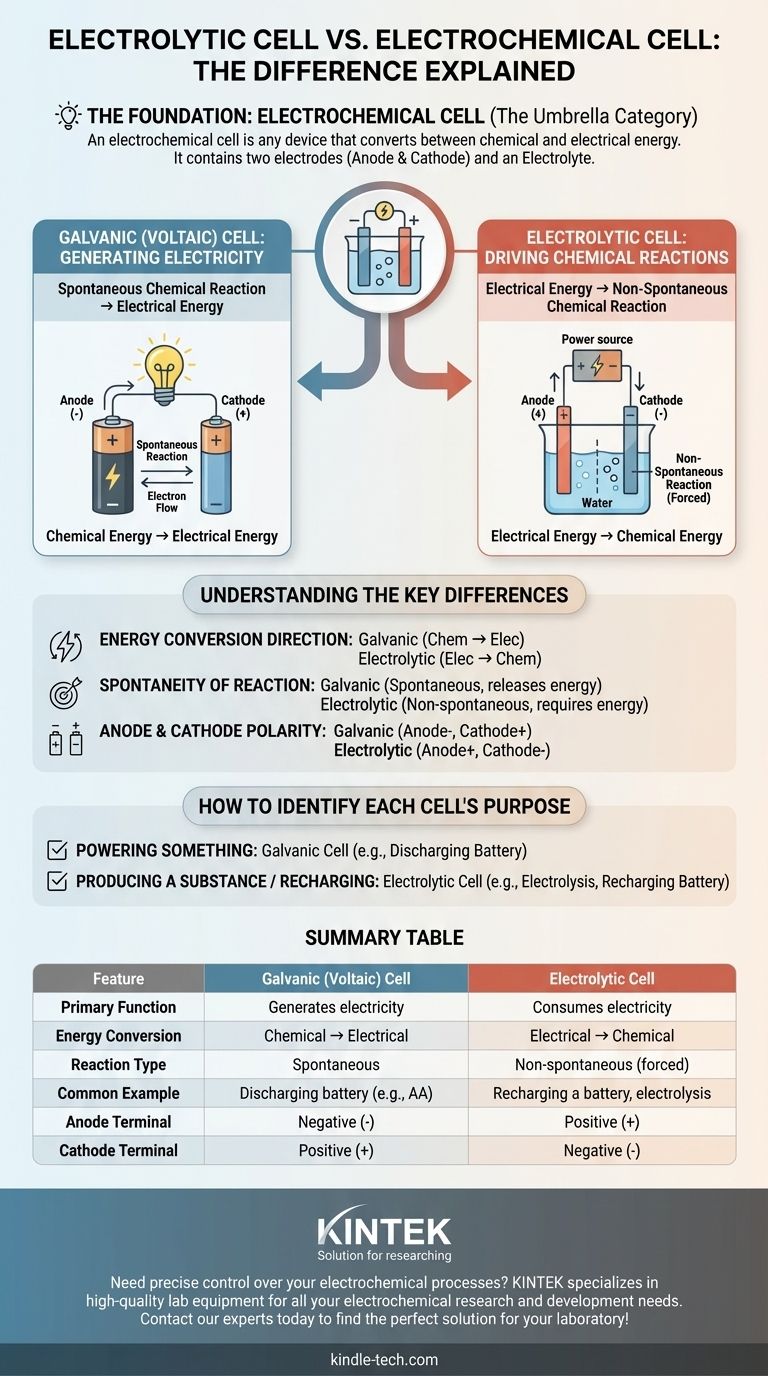
A principal fonte de confusão é que uma célula eletrolítica não é um conceito separado de uma célula eletroquímica — é um dos dois principais tipos de células eletroquímicas. Uma célula eletroquímica é a categoria ampla para qualquer dispositivo que converte energia química em energia elétrica e vice-versa. A verdadeira distinção reside entre células galvânicas (voltaicas), que geram eletricidade a partir de reações químicas, e células eletrolíticas, que usam eletricidade para causar reações químicas.
O termo célula eletroquímica é a categoria abrangente. Os dois tipos específicos sob este guarda-chuva são as células galvânicas (que criam eletricidade) e as células eletrolíticas (que consomem eletricidade). A sua diferença fundamental é a direção da conversão de energia.

A Base: O Que É uma Célula Eletroquímica?
Componentes Essenciais
Uma célula eletroquímica é qualquer dispositivo que contém dois eletrodos (um ânodo e um cátodo) e um eletrólito. Esses componentes trabalham juntos para facilitar a transferência de elétrons, seja criando ou consumindo uma corrente elétrica.
O Propósito Abrangente
O único propósito de uma célula eletroquímica é servir como uma ponte entre a energia química e a energia elétrica. A direção dessa conversão de energia determina o tipo específico de célula.
Os Dois Tipos Fundamentais de Conversão
Células Galvânicas (Voltaicas): Gerando Eletricidade
Uma célula galvânica, também conhecida como célula voltaica, aproveita uma reação química espontânea para produzir energia elétrica.
Pense em uma pilha AA padrão. Os materiais químicos dentro dela reagem naturalmente, liberando energia na forma de corrente elétrica que pode alimentar um dispositivo. Esta é uma célula galvânica em ação.
Células Eletrolíticas: Impulsionando Reações Químicas
Uma célula eletrolítica faz exatamente o oposto. Ela usa uma fonte externa de energia elétrica (como uma fonte de alimentação) para forçar a ocorrência de uma reação química não espontânea.
Um exemplo comum é a eletrólise, como a divisão da água em hidrogênio e oxigênio. Esta reação não acontece por si só; ela requer uma entrada constante de eletricidade, que é a função da célula eletrolítica. Recarregar uma bateria é outro exemplo desse processo.
Compreendendo as Diferenças Chave
Direção da Conversão de Energia
Esta é a distinção mais crítica. Uma célula galvânica converte energia química armazenada em energia elétrica. Uma célula eletrolítica converte energia elétrica fornecida em energia química.
Espontaneidade da Reação
A reação química em uma célula galvânica é espontânea — ela ocorre naturalmente e libera energia.
A reação em uma célula eletrolítica é não espontânea — ela requer uma entrada constante de energia externa para ocorrer.
Polaridade do Ânodo e Cátodo
Este é um ponto comum de confusão, mas segue logicamente do fluxo de energia.
Em uma célula galvânica (bateria descarregando), o ânodo é a fonte de elétrons, tornando-o o terminal negativo, enquanto o cátodo é o terminal positivo.
Em uma célula eletrolítica (bateria recarregando), uma fonte de energia externa inverte o fluxo. O ânodo é onde a oxidação ainda ocorre, mas é forçado a ser o terminal positivo, e o cátodo é o terminal negativo.
Como Identificar o Propósito de Cada Célula
Use a função principal da célula como seu guia para distinguir facilmente entre os dois tipos.
- Se o objetivo principal é alimentar algo: Você está usando uma célula galvânica (voltaica), pois uma reação química espontânea está produzindo eletricidade.
- Se o objetivo principal é produzir uma substância ou recarregar uma bateria: Você está usando uma célula eletrolítica, pois a eletricidade está sendo consumida para forçar uma reação química.
Em última análise, ambas são simplesmente dois lados da mesma moeda eletroquímica, definidas por gerarem ou consumirem energia elétrica.
Tabela Resumo:
| Característica | Célula Galvânica (Voltaica) | Célula Eletrolítica |
|---|---|---|
| Função Primária | Gera eletricidade | Consome eletricidade |
| Conversão de Energia | Química → Elétrica | Elétrica → Química |
| Tipo de Reação | Espontânea | Não espontânea (forçada) |
| Exemplo Comum | Bateria descarregando (ex: AA) | Recarga de bateria, eletrólise |
| Terminal do Ânodo | Negativo (-) | Positivo (+) |
| Terminal do Cátodo | Positivo (+) | Negativo (-) |
Precisa de controle preciso sobre seus processos eletroquímicos? A KINTEK é especializada em equipamentos de laboratório de alta qualidade para todas as suas necessidades de pesquisa e desenvolvimento eletroquímico. Seja você desenvolvendo novas tecnologias de bateria ou sintetizando materiais via eletrólise, nossos instrumentos confiáveis garantem resultados precisos e reproduzíveis. Entre em contato com nossos especialistas hoje para encontrar a solução perfeita para o seu laboratório!
Guia Visual
Produtos relacionados
- Célula Eletrolítica Eletroquímica Óptica de Dupla Camada Tipo H com Banho de Água
- Célula Eletrolítica Eletroquímica para Avaliação de Revestimentos
- Célula Eletroquímica Eletrolítica de Quartzo para Experimentos Eletroquímicos
- Célula Eletrolítica Tipo H Tripla Eletroquímica
- Célula Eletrolítica de PTFE Célula Eletroquímica Resistente à Corrosão Selada e Não Selada
As pessoas também perguntam
- Como devem ser manuseados os componentes de vidro de uma célula eletrolítica? Um Guia para Uso Seguro e Eficaz
- Qual é a precaução em relação à temperatura ao usar uma célula eletrolítica totalmente em PTFE? Dicas Essenciais de Segurança Térmica
- Quais são as características estruturais e vantagens da célula eletrolítica totalmente em PTFE? Inércia Química Suprema
- Qual é o propósito de uma célula eletrolítica tipo H com vidro fritado? Prevenir a redeposição de íons e garantir a integridade dos dados
- Por que uma célula eletrolítica tipo H de câmara dupla é necessária para a decomposição de HI sem assistência? Garanta dados cinéticos precisos
- Qual é a função primária e o mecanismo de uma célula eletrolítica? Impulsione Reações Não Espontâneas com Precisão
- Quais propriedades mecânicas e físicas específicas são necessárias para separadores tecidos de PPS em células eletrolíticas de espaço zero?
- Como o eletrólito é gerenciado em células eletrolíticas tipo H para reações específicas? Alcance Controle Preciso e Alta Pureza



















