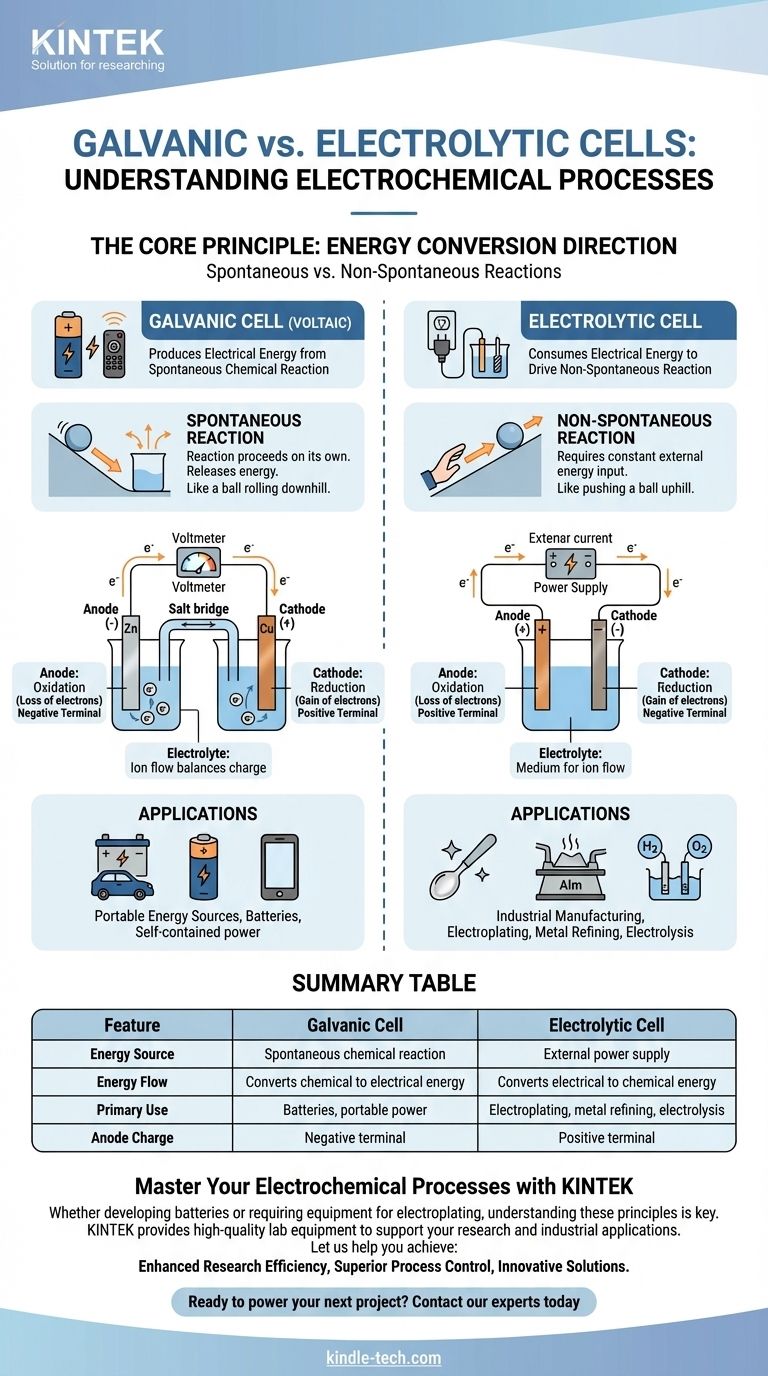
Em sua essência, uma célula galvânica é uma célula eletroquímica que produz energia elétrica a partir de uma reação química espontânea, como uma bateria alimentando seu controle remoto. Em contraste, uma célula eletrolítica consome energia elétrica de uma fonte externa para forçar a ocorrência de uma reação química não espontânea, um processo usado em galvanoplastia e purificação de metais.
A distinção fundamental é a direção da conversão de energia. Uma célula galvânica converte energia química armazenada em energia elétrica, enquanto uma célula eletrolítica converte energia elétrica externa em energia química.

O Princípio Fundamental: Reações Espontâneas vs. Não Espontâneas
O comportamento de qualquer célula eletroquímica é ditado pela tendência natural de sua reação química. Essa tendência é a chave para entender por que uma célula produz energia e a outra a requer.
Como as Células Galvânicas Geram Energia
Uma célula galvânica, também conhecida como célula voltaica, é construída em torno de uma reação química espontânea.
Esta é uma reação que ocorre por si mesma, sem intervenção externa, liberando energia no processo. Pense nisso como uma bola rolando ladeira abaixo.
Essa liberação de energia empurra elétrons através de um circuito externo, criando uma corrente elétrica. Este é o princípio por trás de todas as baterias não recarregáveis e recarregáveis em descarga.
Como as Células Eletrolíticas Consomem Energia
Uma célula eletrolítica impulsiona uma reação química não espontânea.
Esta é uma reação que não ocorrerá por si mesma e requer uma entrada constante de energia para prosseguir. É o equivalente a empurrar uma bola ladeira acima.
Uma fonte de energia externa, como uma fonte de alimentação, fornece a voltagem necessária para forçar os elétrons a fluir contra sua direção natural, impulsionando a mudança química desejada.
Uma Visão Prática da Função da Célula
Embora seus propósitos sejam opostos, ambas as células compartilham componentes comuns que operam sob as mesmas regras fundamentais da química, mas com uma diferença crítica na polaridade.
O Ânodo e o Cátodo: Uma História de Duas Polaridades
Em ambos os tipos de células, o ânodo é sempre onde ocorre a oxidação (perda de elétrons) e o cátodo é onde ocorre a redução (ganho de elétrons).
No entanto, sua carga elétrica é invertida. Em uma célula galvânica, o ânodo é o terminal negativo porque a reação espontânea libera elétrons dele.
Em uma célula eletrolítica, o ânodo é o terminal positivo porque a fonte de energia externa retira elétrons dele, forçando a oxidação a acontecer.
O Papel do Eletrólito
Ambas as células contêm um eletrólito, tipicamente uma solução contendo íons.
Este meio é essencial para completar o circuito elétrico. Enquanto os elétrons fluem através do fio externo, os íons fluem através do eletrólito para equilibrar a carga nos eletrodos.
Compreendendo as Aplicações e Compromissos
As funções opostas dessas células levam a aplicações no mundo real vastamente diferentes e limitações inerentes.
Células Galvânicas: Fontes de Energia Portáteis
O uso principal das células galvânicas é atuar como baterias. Elas fornecem uma fonte de energia elétrica portátil e autônoma.
A desvantagem é que os reagentes químicos dentro da célula são finitos. Uma vez consumidos, a célula para de produzir energia e deve ser descartada ou recarregada.
Células Eletrolíticas: Fabricação Industrial e Purificação
As células eletrolíticas são as ferramentas de trabalho da indústria, usadas para processos que de outra forma seriam quimicamente impossíveis ou ineficientes.
As principais aplicações incluem galvanoplastia (revestimento de um metal com outro), refino de metais como alumínio e cobre, e a eletrólise da água para produzir hidrogênio e oxigênio. Sua principal limitação é a necessidade de um fornecimento significativo e contínuo de energia elétrica externa.
Como Aplicar Este Conhecimento
Sua escolha entre esses conceitos depende inteiramente se seu objetivo é gerar energia ou induzir uma mudança química.
- Se seu foco principal é gerar eletricidade a partir de uma reação química: Você está trabalhando com os princípios de uma célula galvânica, como ao projetar ou entender uma bateria.
- Se seu foco principal é usar eletricidade para criar um produto ou refinar uma substância: Você está trabalhando com os princípios de uma célula eletrolítica, comum na fabricação química e metalurgia.
Compreender essa divisão é o primeiro passo para dominar a aplicação prática da eletroquímica.
Tabela Resumo:
| Característica | Célula Galvânica | Célula Eletrolítica |
|---|---|---|
| Fonte de Energia | Reação química espontânea | Fonte de energia externa |
| Fluxo de Energia | Converte energia química em elétrica | Converte energia elétrica em química |
| Uso Principal | Baterias, energia portátil | Galvanoplastia, refino de metais, eletrólise |
| Carga do Ânodo | Terminal negativo | Terminal positivo |
Domine Seus Processos Eletroquímicos com a KINTEK
Quer você esteja desenvolvendo novas tecnologias de bateria ou precise de equipamentos precisos para galvanoplastia e purificação de metais, entender esses princípios eletroquímicos fundamentais é apenas o começo. A KINTEK é especializada em fornecer equipamentos de laboratório e consumíveis de alta qualidade para apoiar sua pesquisa e aplicações industriais.
Deixe-nos ajudá-lo a alcançar:
- Eficiência de Pesquisa Aprimorada: Com equipamentos confiáveis para testar e desenvolver sistemas galvânicos e eletrolíticos.
- Controle de Processo Superior: Para resultados consistentes em galvanoplastia, eletrólise e síntese de materiais.
- Soluções Inovadoras: Adaptadas às necessidades exclusivas de laboratórios e instalações de produção.
Pronto para impulsionar seu próximo projeto? Entre em contato com nossos especialistas hoje para encontrar a solução perfeita para suas necessidades de laboratório!
Guia Visual
Produtos relacionados
- Célula Eletrolítica Eletroquímica Óptica de Dupla Camada Tipo H com Banho de Água
- Célula Eletrolítica Eletroquímica para Avaliação de Revestimentos
- Célula Eletroquímica Eletrolítica de Quartzo para Experimentos Eletroquímicos
- Célula Eletrolítica Tipo H Tripla Eletroquímica
- Célula Eletrolítica de PTFE Célula Eletroquímica Resistente à Corrosão Selada e Não Selada
As pessoas também perguntam
- Qual é o propósito da estrutura de dupla camada na célula eletrolítica tipo H? Alcançar Controle Térmico Preciso
- O que é uma célula tipo H? Um Guia para Células Eletroquímicas Divididas para Experimentos Precisos
- Quais são as especificações padrão de abertura para uma célula eletrolítica de membrana permutável tipo H? Portas Assimétricas para Eletroquímica Precisa
- Como deve ser armazenada a célula eletrolítica tipo H quando não estiver em uso? Guia Especializado de Armazenamento e Manutenção
- Qual é a estrutura de uma célula eletrolítica de membrana intercambiável tipo H? Um guia para separação eletroquímica precisa



















