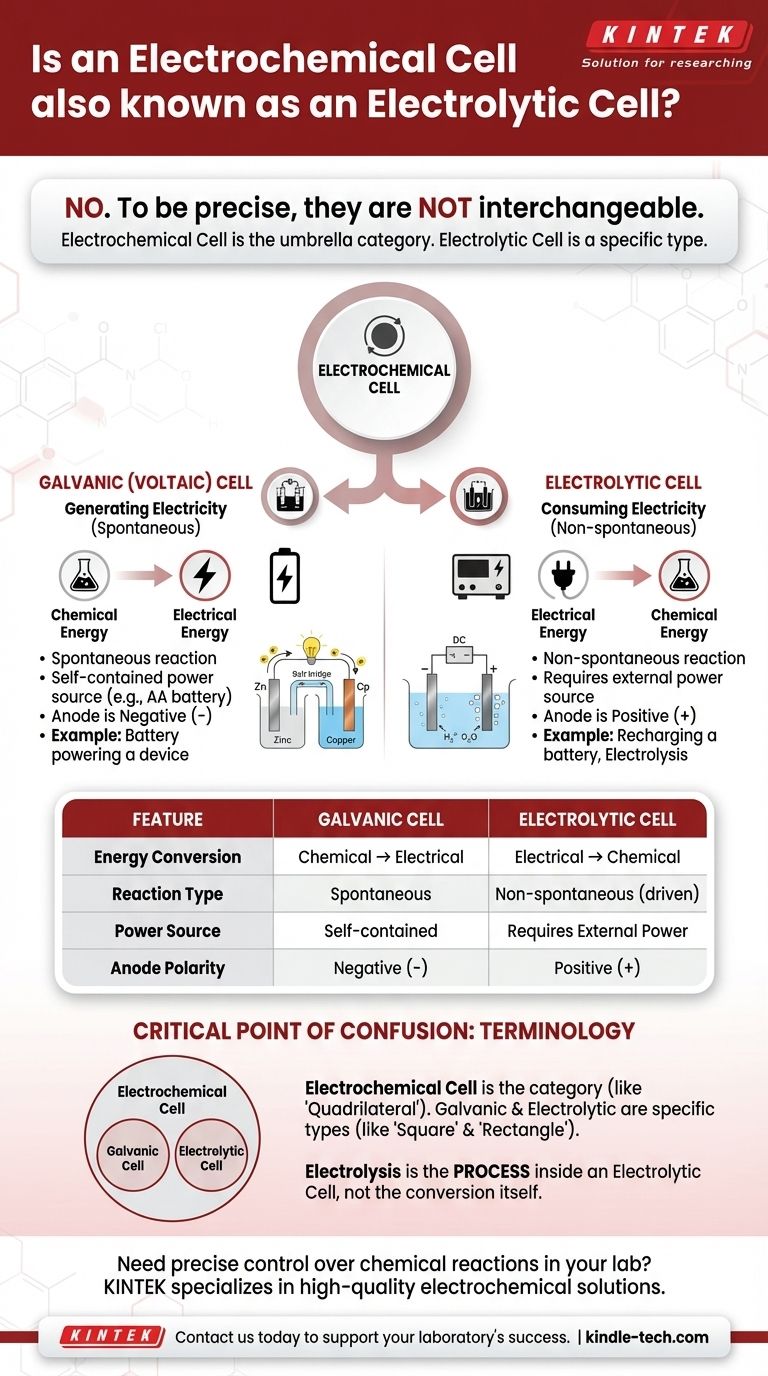
Para ser preciso, não. Uma célula eletrolítica é um tipo específico de célula eletroquímica, mas os dois termos não são intercambiáveis. "Célula eletroquímica" é a categoria ampla e abrangente para qualquer dispositivo que converte energia química em energia elétrica ou vice-versa. Células eletrolíticas são o tipo que especificamente usa energia elétrica para provocar uma reação química.
A distinção central reside na direção da conversão de energia. Uma célula galvânica (ou voltaica) libera espontaneamente energia de uma reação química para criar eletricidade. Uma célula eletrolítica consome eletricidade de uma fonte externa para forçar a ocorrência de uma reação química.

A Distinção Fundamental: Fluxo de Energia
O propósito de uma célula eletroquímica dita sua classificação. A pergunta principal a ser feita é se a célula está produzindo energia ou consumindo-a.
Células Galvânicas (Voltaicas): Gerando Eletricidade
Uma célula galvânica, também conhecida como célula voltaica, aproveita uma reação química espontânea.
Os reagentes dentro da célula têm uma tendência natural de reagir, liberando energia no processo. Essa energia é capturada como uma corrente elétrica.
Pense em uma pilha AA padrão em um controle remoto. É uma célula galvânica, convertendo sua energia química interna na energia elétrica necessária para alimentar o controle.
Células Eletrolíticas: Consumindo Eletricidade
Uma célula eletrolítica usa uma fonte externa de energia elétrica (como uma fonte de alimentação) para conduzir uma reação química não espontânea.
Sem essa energia externa, a reação química não ocorreria por conta própria. A eletricidade força a reação a prosseguir contra sua tendência natural.
Um exemplo comum é a eletrólise, como a decomposição da água em gás hidrogênio e oxigênio. Outro é o recarregamento de uma bateria de íon-lítio; você está usando eletricidade para reverter a reação de descarga e restaurar seu potencial químico.
Identificadores Chave para Cada Tipo de Célula
Além da direção do fluxo de energia, algumas características técnicas ajudam a diferenciar os dois tipos de células.
O Papel de uma Fonte de Energia Externa
Este é o indicador mais direto. Se um dispositivo é autônomo e atua como uma fonte de energia, é uma célula galvânica.
Se o dispositivo precisa ser conectado a uma fonte de energia externa para funcionar, é uma célula eletrolítica.
Polaridade do Ânodo e do Cátodo
Embora as definições de ânodo (onde ocorre a oxidação) e cátodo (onde ocorre a redução) permaneçam constantes, sua carga elétrica (polaridade) se inverte entre os dois tipos de células.
Em uma célula galvânica, o ânodo é o terminal negativo (-) e o cátodo é o terminal positivo (+).
Em uma célula eletrolítica, a fonte de energia externa inverte isso. O ânodo se torna o terminal positivo (+) e o cátodo se torna o terminal negativo (-).
O Ponto Crítico de Confusão: Terminologia
A principal fonte de confusão decorre da natureza sobreposta, mas distinta, dos termos. Falhar em diferenciá-los leva a mal-entendidos fundamentais.
"Célula Eletroquímica" é o Termo Abrangente
Pense em "célula eletroquímica" como a categoria geral, como "quadrilátero".
Células galvânicas e células eletrolíticas são os tipos específicos dentro dessa categoria, muito como "quadrado" e "retângulo" são tipos específicos de quadriláteros. Uma célula eletrolítica é sempre uma célula eletroquímica, mas nem todas as células eletroquímicas são eletrolíticas.
O Uso Incorreto de "Eletrólise"
Eletrólise é o processo de usar eletricidade para conduzir uma reação química. Esse processo ocorre dentro de uma célula eletrolítica.
Algumas definições afirmam incorretamente que eletrólise é a conversão de energia química em elétrica. Isso é o oposto da verdade. A eletrólise é fundamentalmente sobre o uso de eletricidade para criar uma mudança química.
Fazendo a Distinção Correta para o Seu Objetivo
Para aplicar esse conhecimento corretamente, simplesmente identifique a função principal do dispositivo que você está analisando.
- Se o seu foco é em um dispositivo que está fornecendo energia para algo (um controle remoto, um telefone, um relógio): Você está lidando com uma célula galvânica (voltaica), que converte energia química armazenada em eletricidade.
- Se o seu foco é em um processo que usa eletricidade para criar uma substância (recarregar uma bateria, banhar metal, produzir gás cloro): Você está lidando com uma célula eletrolítica, que usa energia elétrica para forçar uma mudança química.
- Se você está descrevendo o campo geral ou um dispositivo com capacidades duplas (como uma bateria recarregável): O termo "célula eletroquímica" é a escolha correta e mais inclusiva.
Compreender a direção da conversão de energia é a chave para dominar este conceito fundamental em química e engenharia.
Tabela de Resumo:
| Característica | Célula Galvânica (Voltaica) | Célula Eletrolítica |
|---|---|---|
| Conversão de Energia | Química → Elétrica | Elétrica → Química |
| Tipo de Reação | Espontânea | Não espontânea (forçada) |
| Fonte de Energia | Autônoma (ex: bateria) | Requer fonte de alimentação externa |
| Polaridade do Ânodo | Terminal Negativo (-) | Terminal Positivo (+) |
| Exemplo Comum | Pilha AA em um controle remoto | Recarregamento de uma bateria de íon-lítio |
Precisa de controle preciso sobre reações químicas no seu laboratório? Entender o tipo certo de célula eletroquímica é crucial para sua pesquisa e processos. Na KINTEK, nos especializamos em fornecer equipamentos de laboratório e consumíveis de alta qualidade adaptados às suas necessidades eletroquímicas específicas. Se você está trabalhando com células galvânicas para geração de energia ou células eletrolíticas para síntese, nossas soluções garantem precisão e confiabilidade. Entre em contato conosco hoje para discutir como podemos apoiar o sucesso do seu laboratório!
Guia Visual
Produtos relacionados
- Célula Eletrolítica Eletroquímica Óptica de Dupla Camada Tipo H com Banho de Água
- Célula Eletrolítica Eletroquímica para Avaliação de Revestimentos
- Célula Eletroquímica Eletrolítica de Quartzo para Experimentos Eletroquímicos
- Célula Eletrolítica Tipo H Tripla Eletroquímica
- Célula Eletrolítica de PTFE Célula Eletroquímica Resistente à Corrosão Selada e Não Selada
As pessoas também perguntam
- Quais são as especificações padrão de abertura para uma célula eletrolítica de membrana permutável tipo H? Portas Assimétricas para Eletroquímica Precisa
- Qual é a estrutura geral da célula eletrolítica de banho-maria óptico de dupla camada tipo H? Design de Precisão para Experimentos Controlados
- O que é uma célula tipo H? Um Guia para Células Eletroquímicas Divididas para Experimentos Precisos
- Qual é a estrutura de uma célula eletrolítica de membrana intercambiável tipo H? Um guia para separação eletroquímica precisa
- Quais são as principais características de uma célula eletrolítica de banho-maria de dupla camada? Obtenha Controle Preciso de Temperatura para Seus Experimentos



















