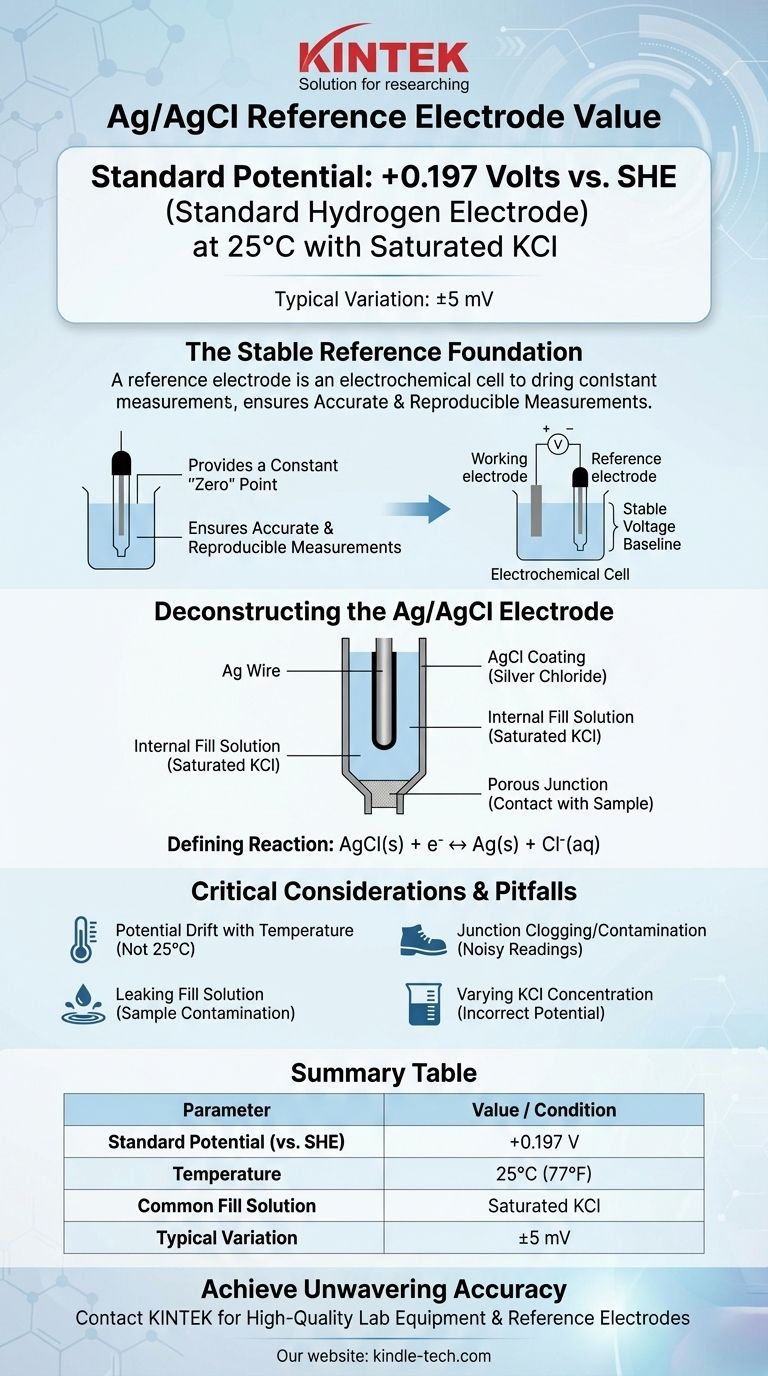
Em sua configuração mais comum, o eletrodo de referência de prata/cloreto de prata (Ag/AgCl) tem um potencial de +0,197 Volts em relação ao Eletrodo Padrão de Hidrogênio (SHE) a 25°C. Este valor assume que o eletrodo está usando uma solução de preenchimento de cloreto de potássio (KCl) saturada. Pequenas variações, frequentemente citadas como +199 mV (±5mV), são comuns devido a pequenas diferenças na preparação e nas condições.
A função principal de um eletrodo de referência é fornecer uma linha de base de voltagem inabalável e estável. Compreender que o potencial do eletrodo Ag/AgCl é definido por um equilíbrio químico específico e é sensível à concentração de cloreto e à temperatura é a chave para usá-lo em medições precisas e reproduzíveis.

O Papel de uma Referência Estável
Estabelecendo um Ponto Zero
Todas as medições de voltagem são inerentemente uma diferença de potencial entre dois pontos. Em eletroquímica, não é possível medir o potencial absoluto de um único eletrodo de trabalho.
Um eletrodo de referência fornece um potencial constante e conhecido que serve como o ponto "zero" estável. Todos os outros potenciais em sua célula eletroquímica são então medidos em relação a esta referência inabalável.
Como Ele Alcança Estabilidade
Um eletrodo de referência ideal é descrito como "bem equilibrado". Isso significa que seu potencial é governado por uma reação química rápida e reversível que não é significativamente perturbada pela pequena quantidade de corrente que flui durante a medição.
Para o eletrodo Ag/AgCl, essa estabilidade vem do equilíbrio entre o cloreto de prata sólido e os íons prata e cloreto.
Desconstruindo o Eletrodo Ag/AgCl
Os Componentes Principais
Um eletrodo Ag/AgCl típico consiste em um fio de prata (Ag) que foi revestido com uma camada de cloreto de prata sólido (AgCl).
Todo este conjunto é imerso em uma solução de preenchimento interna que contém uma concentração conhecida e fixa de íons cloreto (Cl⁻), mais comumente cloreto de potássio (KCl). Uma junção porosa, frequentemente feita de cerâmica ou algodão, permite o contato elétrico com a solução da amostra.
A Reação Eletroquímica Definidora
O potencial do eletrodo é estabelecido por uma reação de meia-célula simples e reversível:
AgCl(s) + e⁻ ↔ Ag(s) + Cl⁻(aq)
O potencial deste equilíbrio depende diretamente da atividade (efetivamente, da concentração) dos íons cloreto na solução de preenchimento.
Por Que a Solução de Preenchimento é Crítica
Como o potencial depende da concentração de cloreto, seu valor deve ser fixo e conhecido.
KCl saturado é a escolha mais comum porque é fácil de preparar e manter. Enquanto houver cristais sólidos de KCl presentes, a solução permanece saturada, garantindo uma atividade de cloreto constante e, portanto, um potencial estável de +0,197 V.
Outras concentrações, como 3M ou 1M KCl, também são usadas e resultarão em diferentes potenciais de referência.
Compreendendo as Vantagens e Armadilhas
Variação Potencial com a Temperatura
O potencial padrão de +0,197 V é válido apenas a 25°C (77°F). O potencial do eletrodo mudará previsivelmente com a temperatura. Para trabalhos de alta precisão, essa dependência da temperatura deve ser considerada ou controlada.
Entupimento e Contaminação da Junção
A junção porosa é o ponto mais comum de falha. Se ela ficar entupida com material da amostra ou se o eletrólito interno cristalizar dentro dela, a conexão elétrica é interrompida, levando a leituras ruidosas ou completamente instáveis.
Vazamento da Solução de Preenchimento
A solução de preenchimento interna vaza lentamente através da junção por projeto. Se sua amostra for sensível a íons cloreto ou potássio, esse vazamento pode causar contaminação ou reações secundárias indesejáveis, interferindo em sua medição. Nesses casos, um eletrodo de dupla junção com um eletrólito externo diferente pode ser necessário.
Assumindo KCl Saturado
Nunca assuma que seu eletrodo Ag/AgCl usa uma solução de KCl saturada. Sempre verifique a concentração da solução de preenchimento, pois usar o potencial de referência errado em seus cálculos é uma fonte fundamental de erro. Um eletrodo com 3M KCl, por exemplo, tem um potencial mais próximo de +0,210 V vs. SHE.
Fazendo a Escolha Certa para o Seu Objetivo
Para garantir que suas medições sejam precisas, você deve tratar seu eletrodo de referência como o instrumento crítico que ele é.
- Se seu foco principal for análise de rotina (por exemplo, medição de pH): Use um eletrodo comercial selado, armazene-o adequadamente em sua solução de armazenamento designada para manter a junção úmida e substitua-o quando as leituras se tornarem instáveis.
- Se seu foco principal for pesquisa de alta precisão (por exemplo, estudos de corrosão): Sempre relate o eletrodo de referência específico usado (por exemplo, Ag/AgCl, KCl sat.) junto com seus dados, monitore a deriva e considere calibrá-lo contra um padrão recém-preparado.
- Se seu foco principal for evitar a contaminação da amostra: Selecione um eletrodo de dupla junção ou um com uma solução de preenchimento quimicamente compatível com sua amostra para evitar precipitação ou interferência na junção líquida.
Um eletrodo de referência confiável é a base de qualquer medição eletroquímica precisa.
Tabela Resumo:
| Parâmetro | Valor / Condição |
|---|---|
| Potencial Padrão (vs. SHE) | +0,197 V |
| Temperatura | 25°C (77°F) |
| Solução de Preenchimento Comum | KCl Saturado |
| Variação Típica | ±5 mV |
Alcance Precisão Inabalável em Seu Laboratório
Suas medições eletroquímicas são tão confiáveis quanto seu eletrodo de referência. A KINTEK é especializada em equipamentos e consumíveis de laboratório de alta qualidade, fornecendo os eletrodos de referência Ag/AgCl precisos e estáveis que seu laboratório precisa para resultados reproduzíveis.
Deixe nossos especialistas ajudá-lo a selecionar o eletrodo de referência perfeito para sua aplicação — seja para análise de rotina ou pesquisa de alta precisão.
Entre em contato com a KINTEK hoje para garantir que suas medições sejam construídas sobre uma base sólida.
Guia Visual
Produtos relacionados
- Eletrodo de Disco de Platina Rotativo para Aplicações Eletroquímicas
- Eletrodo de Referência de Sulfato de Cobre para Uso em Laboratório
- Eletrodo de Disco de Ouro
- Eletrodo Auxiliar de Platina para Uso Laboratorial
- Eletrodo de disco rotativo (disco de anel) RRDE / compatível com PINE, ALS japonês, Metrohm suíço de carbono vítreo platina
As pessoas também perguntam
- O que é o método do eletrodo de disco-anel rotativo? Desbloqueie a Análise de Reação em Tempo Real
- Como um eletrodo de fio/haste de platina deve ser limpo antes do uso? Um Guia para Dados Eletroquímicos Confiáveis
- Qual é uma aplicação comum para o eletrodo de fio/haste de platina? O Guia Essencial para Contraeletrodos
- Quais são as especificações do Eletrodo Funcional de Platina-Titânio? Maximize o Desempenho Eletroquímico
- O que é o RRDE em eletroquímica? Desvende Caminhos de Reação Detalhados com Análise de Eletrodo Duplo



















