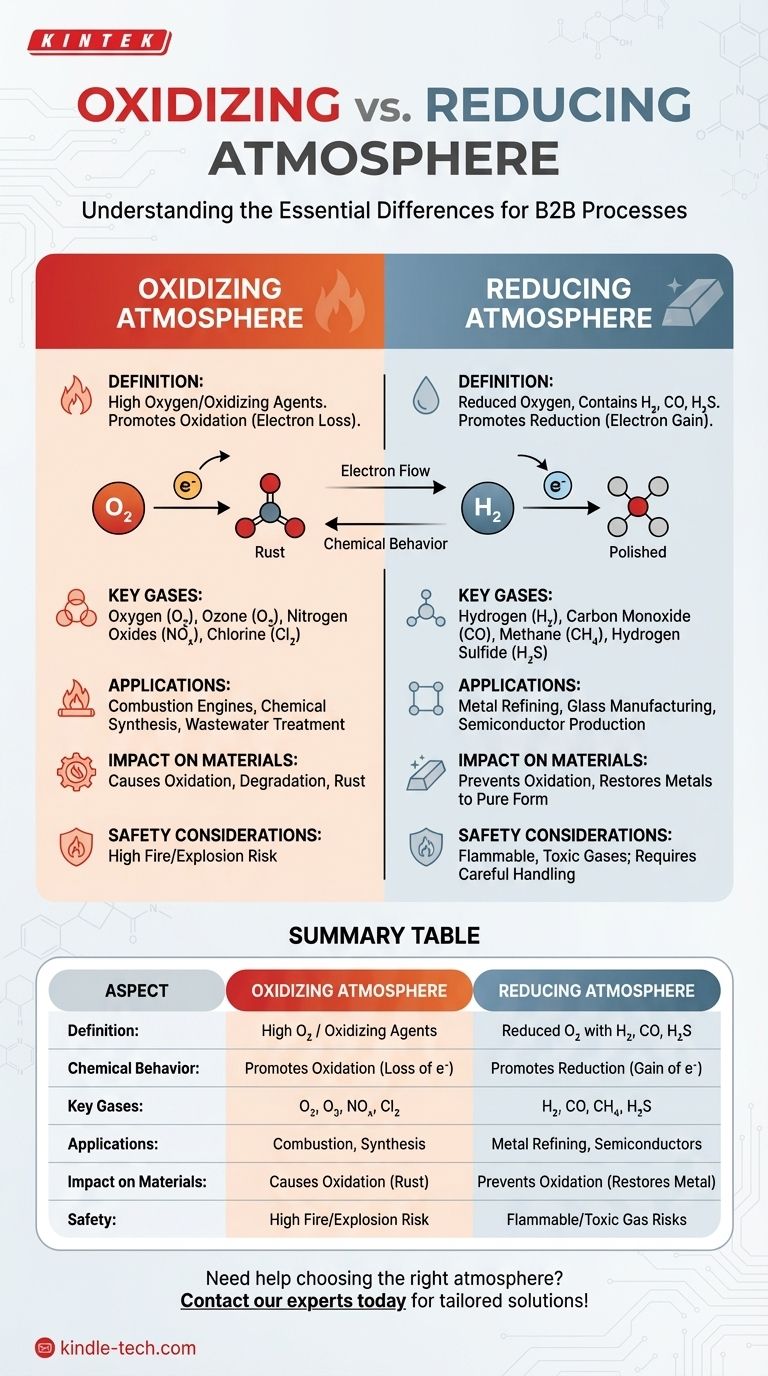
Uma atmosfera oxidante contém uma alta concentração de oxigênio ou outros agentes oxidantes, promovendo reações de oxidação, enquanto uma atmosfera redutora tem uma quantidade reduzida de oxigênio e pode conter gases como hidrogênio, monóxido de carbono ou sulfeto de hidrogênio, que previnem a oxidação e incentivam reações de redução. A principal diferença reside no comportamento químico do ambiente: atmosferas oxidantes facilitam a perda de elétrons (oxidação), enquanto atmosferas redutoras promovem o ganho de elétrons (redução). Essas diferenças são críticas em aplicações como metalurgia, fabricação química e processamento de materiais, onde o controle da atmosfera pode impactar significativamente o resultado das reações.

Pontos Chave Explicados:
-
Definição de Atmosfera Oxidante:
- Uma atmosfera oxidante é caracterizada por uma alta concentração de oxigênio ou outros agentes oxidantes.
- Promove reações de oxidação, onde as substâncias perdem elétrons.
- Exemplos comuns incluem o ar (que contém ~21% de oxigênio) e ambientes com ozônio ou óxidos de nitrogênio.
- Aplicações incluem processos de combustão, ferrugem de metais e certas sínteses químicas.
-
Definição de Atmosfera Redutora:
- Uma atmosfera redutora contém uma quantidade reduzida de oxigênio e pode incluir gases como hidrogênio, monóxido de carbono ou sulfeto de hidrogênio.
- Previne a oxidação e incentiva reações de redução, onde as substâncias ganham elétrons.
- Exemplos comuns incluem ambientes usados em processos metalúrgicos (ex: fundição) ou preservação de alimentos (ex: embalagem a vácuo).
- Aplicações incluem refino de metais, fabricação de vidro e produção de semicondutores.
-
Comportamento Químico:
- Atmosfera Oxidante: Facilita a perda de elétrons das substâncias, levando à oxidação. Por exemplo, o ferro reage com o oxigênio para formar óxido de ferro (ferrugem).
- Atmosfera Redutora: Promove o ganho de elétrons, levando à redução. Por exemplo, o gás hidrogênio pode reduzir o óxido de ferro de volta a ferro metálico.
-
Gases Chave Envolvidos:
- Atmosfera Oxidante: Oxigênio (O₂), ozônio (O₃), óxidos de nitrogênio (NOₓ) e cloro (Cl₂).
- Atmosfera Redutora: Hidrogênio (H₂), monóxido de carbono (CO), metano (CH₄) e sulfeto de hidrogênio (H₂S).
-
Aplicações e Implicações:
-
Atmosfera Oxidante:
- Usada em motores de combustão, síntese química (ex: produção de ácido sulfúrico) e tratamento de águas residuais.
- Pode causar corrosão ou degradação de materiais ao longo do tempo.
-
Atmosfera Redutora:
- Usada na extração de metais (ex: redução de minério de ferro para ferro), fabricação de vidro (para remover impurezas) e embalagem de alimentos (para prevenir deterioração).
- Previne a oxidação, preservando a integridade de materiais ou produtos.
-
Atmosfera Oxidante:
-
Exemplos na Indústria:
- Atmosfera Oxidante: Na produção de aço, oxigênio é soprado no ferro fundido para remover impurezas (ex: carbono) através da oxidação.
- Atmosfera Redutora: Na produção de wafers de silício para semicondutores, uma atmosfera redutora é usada para prevenir a oxidação da superfície do silício.
-
Impacto nos Materiais:
- Atmosfera Oxidante: Pode levar à formação de óxidos, o que pode degradar materiais (ex: ferrugem em metais).
- Atmosfera Redutora: Pode restaurar metais à sua forma pura removendo óxidos (ex: redução de óxido de ferro para ferro).
-
Considerações Ambientais e de Segurança:
- Atmosfera Oxidante: Níveis elevados de oxigênio aumentam o risco de incêndio ou explosões.
- Atmosfera Redutora: Gases como hidrogênio ou monóxido de carbono são inflamáveis e tóxicos, exigindo manuseio cuidadoso.
Ao entender essas diferenças, os compradores de equipamentos e consumíveis podem tomar decisões informadas sobre o tipo de atmosfera necessária para processos específicos, garantindo resultados ótimos e segurança.
Tabela de Resumo:
| Aspecto | Atmosfera Oxidante | Atmosfera Redutora |
|---|---|---|
| Definição | Alta concentração de oxigênio ou agentes oxidantes. | Níveis reduzidos de oxigênio com gases como hidrogênio, monóxido de carbono ou sulfeto de hidrogênio. |
| Comportamento Químico | Promove oxidação (perda de elétrons). | Promove redução (ganho de elétrons). |
| Gases Chave | Oxigênio (O₂), ozônio (O₃), óxidos de nitrogênio (NOₓ), cloro (Cl₂). | Hidrogênio (H₂), monóxido de carbono (CO), metano (CH₄), sulfeto de hidrogênio (H₂S). |
| Aplicações | Motores de combustão, síntese química, tratamento de águas residuais. | Refino de metais, fabricação de vidro, produção de semicondutores. |
| Impacto nos Materiais | Causa oxidação (ex: ferrugem). | Previne a oxidação, restaura metais à forma pura. |
| Considerações de Segurança | Níveis elevados de oxigênio aumentam riscos de incêndio/explosão. | Gases inflamáveis e tóxicos exigem manuseio cuidadoso. |
Precisa de ajuda para escolher a atmosfera certa para o seu processo? Entre em contato com nossos especialistas hoje mesmo para soluções personalizadas!
Guia Visual
Produtos relacionados
- Forno com Atmosfera Controlada de 1200℃ Forno de Atmosfera Inerte de Nitrogênio
- Forno de Hidrogênio com Atmosfera Inerte Controlada
- Forno com Atmosfera Controlada de 1400℃ com Nitrogênio e Atmosfera Inerte
- Forno de Atmosfera Controlada de 1700℃ Forno de Atmosfera Inerte de Nitrogênio
- Forno Rotativo de Tubo com Múltiplas Zonas de Aquecimento Dividido
As pessoas também perguntam
- Qual é o efeito da atmosfera do forno na análise térmica? Desvende Insights Precisos sobre Materiais
- Que tipo de ambiente um forno tubular de atmosfera fornece para Ti2AlN? Obtenha Resultados de Sinterização de Cerâmica Pura
- Por que o argônio é usado na fabricação de aço? Para Proteção, Pureza e Desempenho Superiores
- Por que o argônio é melhor que o nitrogênio para atmosfera inerte? Garanta Reatividade e Estabilidade Absolutas
- Por que um forno de alta temperatura com controle de atmosfera é necessário para cerâmicas BZY20? Chave para Ativação de Prótons
- Como os fornos de alta temperatura com atmosfera controlada estudam a fadiga por oxidação do 316LN? Domine a Sinergia Destrutiva
- Como um forno de atmosfera dividida de três zonas garante precisão? Dominando a Uniformidade Térmica para Testes de Tração
- Como um forno de atmosfera de alta temperatura influencia as cerâmicas Si-O-C? Controle o seu ambiente de pirólise



















