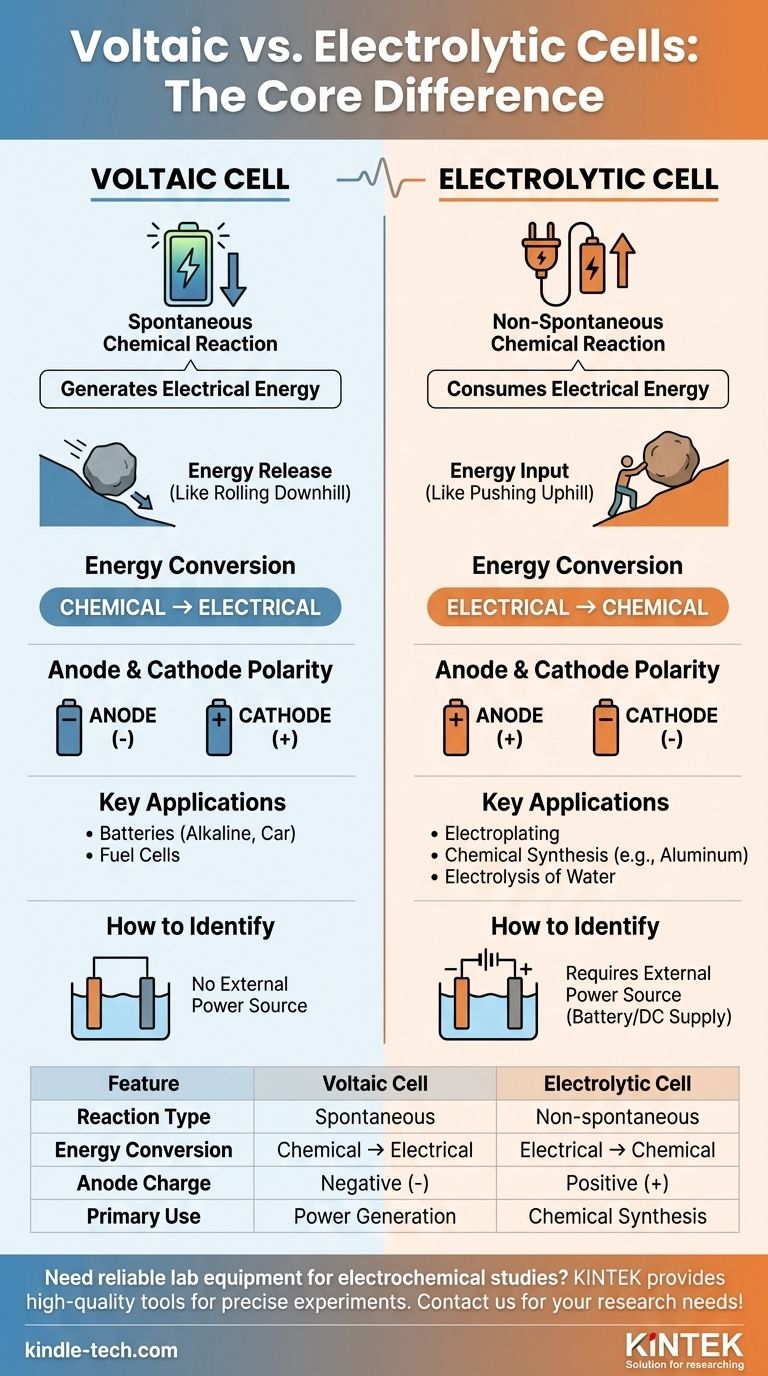
A principal diferença entre uma célula voltaica e uma célula eletrolítica reside no seu propósito fundamental e na natureza das reações químicas envolvidas. Uma célula voltaica, como uma bateria comum, usa uma reação química espontânea para gerar energia elétrica. Em contraste, uma célula eletrolítica usa energia elétrica externa para impulsionar uma reação química que não ocorreria por si mesma.
Em sua essência, a distinção é sobre o fluxo de energia. Uma célula voltaica é uma fonte de energia que libera energia de uma reação química disposta. Uma célula eletrolítica é um consumidor de energia que força a ocorrência de uma reação química indisposta.

O Princípio Central: Espontaneidade
O conceito mais importante que separa essas duas células é se a reação química é espontânea ou não espontânea. Isso dita toda a função e estrutura da célula.
Células Voltaicas: Liberação Espontânea de Energia
Em uma célula voltaica (também chamada de célula galvânica), a reação redox é espontânea. Os reagentes têm maior energia potencial química do que os produtos.
Essa tendência natural de reagir libera energia, que é aproveitada como corrente elétrica. Pense nisso como uma pedra rolando morro abaixo — acontece sem nenhum empurrão externo.
O potencial de célula padrão (E°cell) para uma célula voltaica é sempre positivo, indicando uma reação espontânea.
Células Eletrolíticas: Mudança Química Forçada
Em uma célula eletrolítica, a reação redox é não espontânea. Os produtos estão em um estado de energia mais alto do que os reagentes.
Para que essa reação ocorra, uma fonte de energia externa (como uma bateria ou fonte de corrente contínua) deve ser aplicada. Isso é como empurrar a pedra morro acima — requer uma entrada constante de energia.
O potencial de célula padrão (E°cell) para a reação em uma célula eletrolítica é negativo, confirmando que ela não prosseguirá sem ajuda externa.
Principais Diferenças Funcionais e Estruturais
A diferença na espontaneidade leva a várias distinções cruciais na forma como essas células são construídas e como operam.
Conversão de Energia
Uma célula voltaica realiza a conversão de energia química em energia elétrica. É um gerador de energia química.
Uma célula eletrolítica faz o oposto. Ela converte energia elétrica em energia química, usando energia para criar novas substâncias.
Polaridade do Ânodo e Cátodo
Este é um ponto frequente de confusão, mas é simples se você se lembrar das definições centrais. Em ambos os tipos de células, a oxidação sempre ocorre no ânodo e a redução sempre ocorre no cátodo.
No entanto, a carga desses eletrodos é invertida:
- Em uma célula voltaica, o ânodo é a fonte de elétrons da reação espontânea, tornando-o o terminal negativo (-). O cátodo é onde os elétrons são consumidos, tornando-o o terminal positivo (+).
- Em uma célula eletrolítica, a fonte de energia externa dita a carga. Ela empurra os elétrons para o cátodo, tornando-o o terminal negativo (-). Ela puxa os elétrons para longe do ânodo, tornando-o o terminal positivo (+).
Aplicações Práticas
As aplicações para cada tipo de célula refletem diretamente sua função.
Células voltaicas são usadas para alimentar dispositivos. Exemplos incluem baterias alcalinas comuns, baterias de carro (durante a descarga) e células de combustível.
Células eletrolíticas são usadas para síntese e purificação. Aplicações comuns incluem eletrodeposição de metais, produção de alumínio puro e eletrólise da água para gerar hidrogênio e gás oxigênio.
Armadilhas Comuns e Distinções Chave
Para evitar erros comuns, concentre-se no propósito da célula e na presença de uma fonte de energia externa.
Propósito: Energia vs. Produção
A maneira mais direta de distingui-los é pelo seu objetivo. A célula está produzindo eletricidade ou está usando eletricidade para produzir um produto químico? A primeira é voltaica; a segunda é eletrolítica.
O Papel da Ponte Salina
As células voltaicas geralmente consistem em duas semicélulas separadas conectadas por uma ponte salina. Este componente é crucial para manter a neutralidade de carga à medida que os íons fluem durante a reação espontânea.
As células eletrolíticas são tipicamente mais simples em construção, muitas vezes ocorrendo em um único recipiente onde o próprio eletrólito permite o movimento de íons.
A Fonte de Alimentação Externa
O indicador visual mais claro em um diagrama é a presença de uma bateria ou fonte de alimentação. Se você vir uma conectada aos eletrodos, você está olhando para uma célula eletrolítica. Sua ausência implica uma célula voltaica.
Fazendo a Escolha Certa para o Seu Objetivo
Para identificar o tipo de célula ou entender sua função, considere o objetivo principal do sistema.
- Se o seu foco principal é alimentar um dispositivo: Você está trabalhando com uma célula voltaica, que aproveita uma reação química espontânea para produzir corrente.
- Se o seu foco principal é produzir uma substância pura (como gás cloro ou metal cobre): Você está usando uma célula eletrolítica, que impulsiona uma reação não espontânea com uma fonte de energia externa.
- Se você está analisando um diagrama com uma bateria externa: Isso significa uma célula eletrolítica, pois ela fornece a energia necessária para forçar a mudança química.
Compreender essa divisão fundamental entre geração espontânea e reação forçada é a chave para dominar a eletroquímica.
Tabela Resumo:
| Característica | Célula Voltaica | Célula Eletrolítica |
|---|---|---|
| Tipo de Reação | Espontânea | Não espontânea (requer energia externa) |
| Conversão de Energia | Química → Elétrica | Elétrica → Química |
| Carga do Ânodo | Negativa (-) | Positiva (+) |
| Uso Principal | Geração de energia (ex: baterias) | Síntese química (ex: eletrodeposição) |
Precisa de equipamentos de laboratório confiáveis para seus estudos eletroquímicos? A KINTEK é especializada em equipamentos e consumíveis de laboratório de alta qualidade, fornecendo as ferramentas precisas de que você precisa para experimentos envolvendo células voltaicas e eletrolíticas. De eletrodos a fontes de alimentação, nossas soluções ajudam a garantir resultados precisos e reproduzíveis em seu laboratório. Entre em contato conosco hoje para encontrar o equipamento perfeito para suas necessidades de pesquisa!
Guia Visual
Produtos relacionados
- Célula Eletrolítica Eletroquímica para Avaliação de Revestimentos
- Célula Eletroquímica Eletrolítica com Cinco Portas
- Célula de Gás de Eletrólise Eletroquímica Eletrolítica Célula de Reação de Fluxo Líquido
- Banho de Água de Célula Eletroquímica Eletrolítica Multifuncional Camada Única Dupla Camada
- Equipamento de Laboratório de Baterias Testador Abrangente de Capacidade de Bateria
As pessoas também perguntam
- Como o sistema de célula eletroquímica garante a precisão da medição durante os testes de Reativação Eletroquímica Potencioscinética de Duplo Ciclo (DL-EPR) de aço inoxidável super duplex?
- Como uma célula eletrolítica de alta precisão é usada para avaliar a resistência à corrosão de metais? Valide os resultados do DCT com precisão
- Para que tipo de sistema de eletrodos é projetada a célula eletrolítica de avaliação de revestimento? Desbloqueie a Análise Precisa de Revestimentos
- Qual é o papel de uma célula eletrolítica encamisada a água nas medições de corrosão eletroquímica com temperatura variável?
- Como funciona uma célula eletrolítica de três eletrodos? Testes de precisão para aço 8620 em ambientes corrosivos














