Em qualquer sistema eletroquímico, as duas precauções mais críticas são garantir a polaridade correta do eletrodo e selecionar o eletrólito apropriado para sua reação. A polaridade dita qual processo químico ocorre onde, enquanto o eletrólito fornece o meio necessário para esse processo. Errar em qualquer um deles pode levar a experimentos fracassados, equipamentos danificados ou riscos de segurança significativos.
A polaridade dos seus eletrodos define a direção da reação química, e o eletrólito determina a sua viabilidade. A incompatibilidade de qualquer um deles alterará fundamentalmente, inibirá ou corromperá ativamente o processo eletroquímico pretendido.
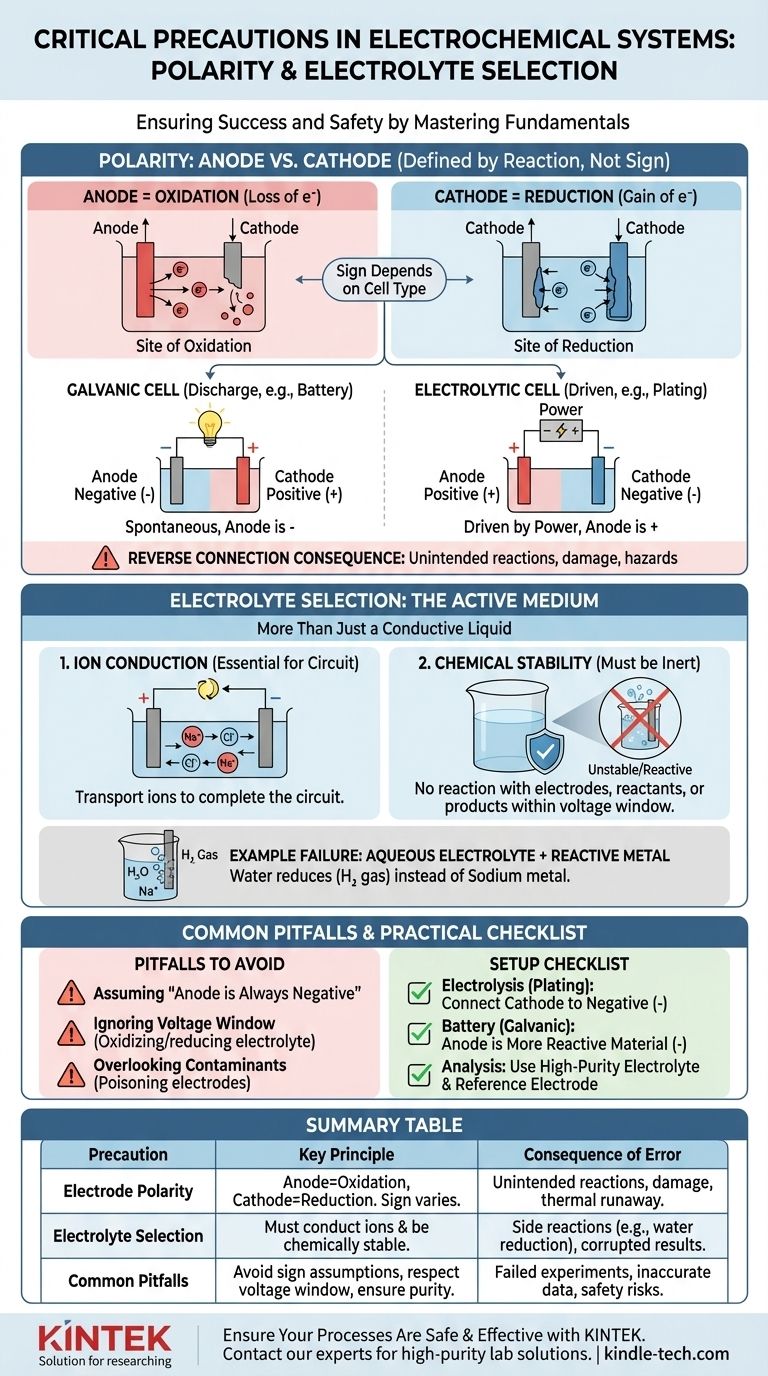
O Papel Crítico da Polaridade: Ânodo vs. Cátodo
Identificar corretamente seu ânodo e cátodo é o primeiro passo para construir uma célula eletroquímica funcional e previsível. Isso vai além de simplesmente rotular os terminais como "positivo" ou "negativo".
O Que "Polaridade" Realmente Significa
Os termos ânodo e cátodo são definidos pelo tipo de reação, e não pela sua carga.
- O Ânodo é sempre o local da Oxidação (perda de elétrons).
- O Cátodo é sempre o local da Redução (ganho de elétrons).
A confusão surge porque o sinal (+ ou -) desses eletrodos depende do tipo de célula. Em uma bateria em descarga (célula galvânica), o ânodo é o terminal negativo. Em uma configuração de eletrólise (célula eletrolítica), o ânodo é conectado ao terminal positivo da fonte de alimentação.
A Consequência da Conexão Invertida
Conectar os eletrodos incorretamente força as reações químicas a ocorrerem no sentido inverso ou de maneira não intencional.
Em uma célula eletrolítica (por exemplo, eletrodeposição), uma conexão invertida significa que você removerá material do eletrodo que pretendia revestir e depositará material no seu ânodo de origem, destruindo ambos.
Em uma bateria recarregável, carregar com polaridade invertida pode causar danos irreversíveis às estruturas dos eletrodos, levando à perda permanente de capacidade, curtos-circuitos internos e potencial fuga térmica perigosa.
Seleção do Eletrólito: Mais do que Apenas um Líquido Condutor
O eletrólito não é um componente passivo; é uma parte ativa e crítica do sistema eletroquímico. Suas propriedades ditam quais reações são sequer possíveis.
A Função Primária: Condução de Íons
A função mais básica do eletrólito é transportar íons entre o ânodo e o cátodo, completando o circuito elétrico. Sem um meio para o fluxo de íons, toda a reação pararia instantaneamente.
A Função Crítica: Estabilidade Química
O eletrólito e seu solvente devem ser quimicamente inertes sob as condições de operação. Eles não devem reagir com os eletrodos, os reagentes ou os produtos da sua reação primária. Esta é a origem das "reações colaterais indesejadas" mencionadas nos protocolos de segurança.
Exemplo: Por Que Eletrólitos Aquosos Falham para Metais Reativos
Imagine tentar produzir sódio metálico pela eletrólise de uma solução de cloreto de sódio (NaCl) em água.
Você poderia esperar que os íons sódio (Na+) se movessem para o cátodo, ganhassem um elétron e formassem sódio metálico. No entanto, a água (H₂O) também está presente e é muito mais fácil de reduzir do que os íons sódio. Como resultado, você produzirá gás hidrogênio no cátodo, e nenhum sódio metálico se formará. A escolha do eletrólito tornou a reação desejada impossível.
Compreendendo os Compromissos e Armadilhas Comuns
Evitar erros simples exige a compreensão dos princípios subjacentes que governam todas as células eletroquímicas.
Armadilha 1: Assumir "Ânodo é Negativo"
O erro mais comum é identificar incorretamente o ânodo e o cátodo. Lembre-se sempre de defini-los pela reação (oxidação/redução), e não por um sinal fixo. Determine se sua célula é galvânica (espontânea) ou eletrolítica (acionada por energia externa) para atribuir o sinal correto.
Armadilha 2: Ignorar a Janela de Tensão do Eletrólito
Todo eletrólito tem uma janela de potencial de estabilidade. Se você aplicar uma tensão que exceda essa janela, começará a oxidar ou reduzir o próprio eletrólito, e não o seu alvo pretendido. Isso consome energia, cria impurezas e interrompe a reação desejada.
Armadilha 3: Ignorar Contaminantes
Mesmo vestígios de impurezas em um eletrólito podem ter um grande impacto. Contaminantes podem se depositar na superfície de um eletrodo, "envenenando-o" e impedindo a reação pretendida, ou podem atuar como catalisadores para reações colaterais indesejadas que corrompem seus resultados.
Uma Lista de Verificação Prática para Sua Configuração
Use estas diretrizes para garantir que sua configuração experimental esteja correta desde o início.
- Se seu foco principal for eletrólise (por exemplo, revestimento, refino): Conecte o eletrodo que você deseja revestir (o cátodo) ao terminal negativo da fonte de alimentação e o material de origem (o ânodo) ao terminal positivo.
- Se seu foco principal for construir uma bateria (uma célula galvânica): O material quimicamente mais reativo que é oxidado é o seu ânodo (terminal negativo), e o material menos reativo é o seu cátodo (terminal positivo).
- Se seu foco principal for análise eletroquímica precisa: Use um eletrólito de alta pureza, frequentemente desgaseificado, para evitar reações colaterais, e confirme sua configuração de polaridade em relação a um padrão conhecido ou eletrodo de referência.
Ao tratar a polaridade e a escolha do eletrólito como parâmetros fundamentais de projeto, você passa de simplesmente seguir instruções para realmente projetar o resultado eletroquímico desejado.

Tabela de Resumo:
| Precaução | Princípio Chave | Consequência do Erro |
|---|---|---|
| Polaridade do Eletrodo | Ânodo = Local de Oxidação; Cátodo = Local de Redução. O sinal depende do tipo de célula (galvânica vs. eletrolítica). | Conexão invertida causa reações não intencionais (ex: remoção em vez de revestimento), danos ao equipamento ou fuga térmica. |
| Seleção do Eletrólito | Deve conduzir íons e permanecer quimicamente estável sob as condições de operação (janela de tensão). | Eletrólito errado permite reações colaterais (ex: redução da água em vez de deposição de sódio), corrompe resultados e desperdiça energia. |
| Armadilhas Comuns | Assumir que 'o ânodo é sempre negativo'; ignorar a janela de tensão do eletrólito; negligenciar contaminantes. | Experimentos fracassados, dados imprecisos e riscos de segurança devido a processos químicos não intencionais. |
Garanta Que Seus Processos Eletroquímicos Sejam Seguros e Eficazes com a KINTEK
Você está montando um projeto de eletrólise, revestimento ou desenvolvimento de baterias? A polaridade correta do eletrodo e a seleção do eletrólito são inegociáveis para alcançar resultados precisos e manter a segurança. Na KINTEK, especializamo-nos em fornecer equipamentos de laboratório e consumíveis de alta pureza — incluindo células eletroquímicas, eletrólitos puros e fontes de alimentação confiáveis — para apoiar as necessidades exclusivas do seu laboratório.
Deixe-nos ajudá-lo a evitar erros dispendiosos e perigos. Fale com nossos especialistas hoje para discutir sua aplicação específica e descobrir como as soluções da KINTEK podem aprimorar seu fluxo de trabalho eletroquímico.
Guia Visual
Produtos relacionados
- Eletrodo de Disco de Platina Rotativo para Aplicações Eletroquímicas
- Eletrodo de Disco de Ouro
- Eletrodo de Referência de Sulfato de Cobre para Uso em Laboratório
- Eletrodo Auxiliar de Platina para Uso Laboratorial
- Abas de Níquel e Alumínio para Baterias de Lítio de Embalagem Macia
As pessoas também perguntam
- Qual é a diferença entre o eletrodo de disco anelar e o eletrodo de disco rotativo? Desvende Insights Eletroquímicos Mais Profundos
- Qual é a diferença entre RDE e RRDE? Desbloqueie a Análise Avançada de Reações Eletroquímicas
- Qual é uma aplicação comum para o eletrodo de fio/haste de platina? O Guia Essencial para Contraeletrodos
- Qual é a função comum de um eletrodo de disco de platina? Um Guia para o Seu Uso Principal como Eletrodo de Trabalho
- O que é o RRDE em eletroquímica? Desvende Caminhos de Reação Detalhados com Análise de Eletrodo Duplo



















