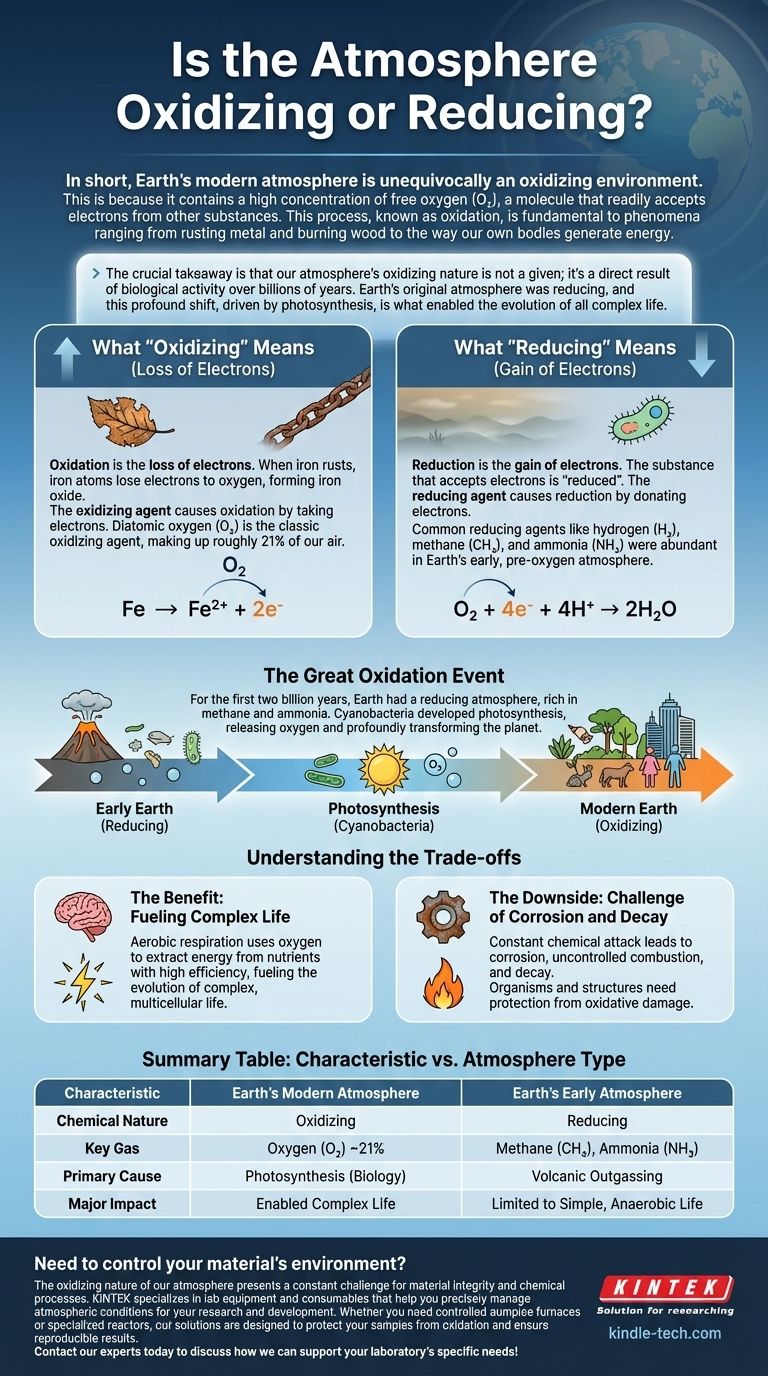
Em resumo, a atmosfera moderna da Terra é inequivocamente um ambiente oxidante. Isso ocorre porque ela contém uma alta concentração de oxigênio livre (O₂), uma molécula que aceita prontamente elétrons de outras substâncias. Esse processo, conhecido como oxidação, é fundamental para fenômenos que vão desde a ferrugem do metal e a queima da madeira até a forma como nossos próprios corpos geram energia.
A conclusão crucial é que a natureza oxidante da nossa atmosfera não é um dado adquirido; é um resultado direto da atividade biológica ao longo de bilhões de anos. A atmosfera original da Terra era redutora, e essa mudança profunda, impulsionada pela fotossíntese, foi o que possibilitou a evolução de toda a vida complexa.

O Que "Oxidante" e "Redutor" Realmente Significam
Para entender o estado da nossa atmosfera, primeiro precisamos definir os princípios químicos centrais em jogo. Esses termos descrevem a transferência de elétrons entre moléculas.
O Papel dos Elétrons
Oxidação é a perda de elétrons. Quando o ferro enferruja, os átomos de ferro perdem elétrons para o oxigênio, formando óxido de ferro.
Redução é o ganho de elétrons. Diz-se que a substância que aceita os elétrons é "reduzida". No exemplo da ferrugem, o oxigênio ganha elétrons do ferro, portanto, o oxigênio é reduzido.
Identificando um Agente Oxidante
Um agente oxidante (ou oxidante) é uma substância que causa oxidação ao retirar elétrons de outra coisa.
Devido à sua poderosa tendência de atrair e aceitar elétrons, o oxigênio diatômico (O₂) é o agente oxidante clássico e mais significativo em nosso ambiente.
Identificando um Agente Redutor
Um agente redutor (ou redutor) é uma substância que causa redução ao doar seus elétrons para outra coisa.
Agentes redutores comuns incluem hidrogênio (H₂), metano (CH₄) e amônia (NH₃). Estes eram abundantes na atmosfera primitiva da Terra, anterior ao oxigênio.
A Força Dominante: Por Que Nossa Atmosfera é Oxidante
A característica química da nossa atmosfera é ditada por uma molécula dominante que compõe aproximadamente 21% do ar que respiramos.
O Fator Oxigênio
A presença de cerca de 21% de oxigênio livre é a principal razão pela qual nossa atmosfera é oxidante. O oxigênio é altamente eletronegativo, o que significa que seus átomos têm uma forte atração por elétrons. Isso torna o O₂ quimicamente agressivo e pronto para reagir com — e oxidar — uma vasta gama de outros elementos e compostos.
O Grande Evento de Oxidação
Nosso planeta nem sempre foi assim. Durante os primeiros dois bilhões de anos de sua história, a Terra tinha uma atmosfera redutora, praticamente livre de O₂ e rica em gases como metano e amônia.
Isso mudou com a evolução das cianobactérias. Esses microrganismos desenvolveram a fotossíntese, um processo que usa a luz solar para criar energia e libera oxigênio como subproduto residual. Ao longo de centenas de milhões de anos, essa atividade biológica transformou lenta e profundamente todo o planeta, bombeando enormes quantidades de O₂ para o ar e mudando-o para seu estado oxidante moderno.
Entendendo as Trocas
Um ambiente oxidante rico em oxigênio apresenta tanto uma grande vantagem quanto um desafio químico persistente.
O Benefício: Alimentando a Vida Complexa
O principal benefício é a respiração aeróbica. Esse processo metabólico usa oxigênio para extrair energia dos nutrientes com eficiência incrível — muito mais do que os processos anaeróbicos (sem oxigênio) que o precederam. Esse excedente maciço de energia foi o que impulsionou a evolução da vida complexa e multicelular, incluindo a nossa.
O Lado Negativo: O Desafio da Corrosão e da Decomposição
O "custo" de uma atmosfera oxidante é o ataque químico constante. Esta é a força por trás da corrosão (como a ferrugem), da combustão descontrolada (fogo) e da decomposição da matéria orgânica.
Os organismos vivos precisam investir energia em defesas antioxidantes sofisticadas para proteger suas células contra danos oxidativos, enquanto qualquer estrutura que construímos deve ser projetada para resistir aos efeitos implacáveis do oxigênio atmosférico.
Conclusões Chave para Diferentes Contextos
Sua abordagem a este fato dependerá de seu campo e de seus objetivos.
- Se seu foco principal for química ou ciência dos materiais: Reconheça que qualquer substância exposta ao nosso ar está em uma batalha constante contra a oxidação, um fator crítico que influencia a seleção, preservação e durabilidade dos materiais.
- Se seu foco principal for biologia ou geologia: Entenda que a mudança de uma atmosfera redutora para uma oxidante foi, sem dúvida, a mudança ambiental mais significativa na história da Terra, ditando todo o curso subsequente da evolução.
- Se seu foco principal for astrobiologia: Use a presença de oxigênio livre substancial na atmosfera de um exoplaneta como uma principal bioassinatura, pois é difícil de ser mantida sem uma fonte biológica poderosa e em escala planetária.
Entender a natureza oxidante da nossa atmosfera é entender o motor químico fundamental que impulsiona tanto a vida quanto a decomposição em nosso mundo.
Tabela de Resumo:
| Característica | Atmosfera Moderna da Terra | Atmosfera Primitiva da Terra |
|---|---|---|
| Natureza Química | Oxidante | Redutora |
| Gás Principal | Oxigênio (O₂) ~21% | Metano (CH₄), Amônia (NH₃) |
| Causa Principal | Fotossíntese (Biologia) | Liberação Vulcânica de Gases |
| Impacto Principal | Possibilitou a Vida Complexa | Limitada à Vida Simples e Anaeróbica |
Precisa controlar o ambiente do seu material? A natureza oxidante da nossa atmosfera apresenta um desafio constante para a integridade do material e processos químicos. A KINTEK é especializada em equipamentos de laboratório e consumíveis que ajudam você a gerenciar com precisão as condições atmosféricas para sua pesquisa e desenvolvimento. Quer você precise de fornos de atmosfera controlada ou reatores especializados, nossas soluções são projetadas para proteger suas amostras da oxidação e garantir resultados reprodutíveis. Entre em contato com nossos especialistas hoje para discutir como podemos apoiar as necessidades específicas do seu laboratório!
Guia Visual
Produtos relacionados
- Forno com Atmosfera Controlada de 1200℃ Forno de Atmosfera Inerte de Nitrogênio
- Forno com Atmosfera Controlada de 1400℃ com Nitrogênio e Atmosfera Inerte
- Forno de Hidrogênio com Atmosfera Inerte Controlada
- Forno de Atmosfera Controlada de 1700℃ Forno de Atmosfera Inerte de Nitrogênio
- Forno de Tubo de Laboratório de Alta Temperatura de 1400℃ com Tubo de Alumina
As pessoas também perguntam
- Como você cria uma atmosfera inerte? Domine Processos Seguros e Puros com Inertização
- Por que o nitrogênio é usado em fornos? Um escudo econômico para processos de alta temperatura
- O que fornece uma atmosfera inerte? Alcance Segurança e Pureza com Nitrogênio, Argônio ou CO2
- O que é uma condição inerte? Um Guia para Prevenir Incêndios e Explosões
- O que significa atmosfera inerte? Um Guia para Prevenir a Oxidação e Garantir a Segurança



















