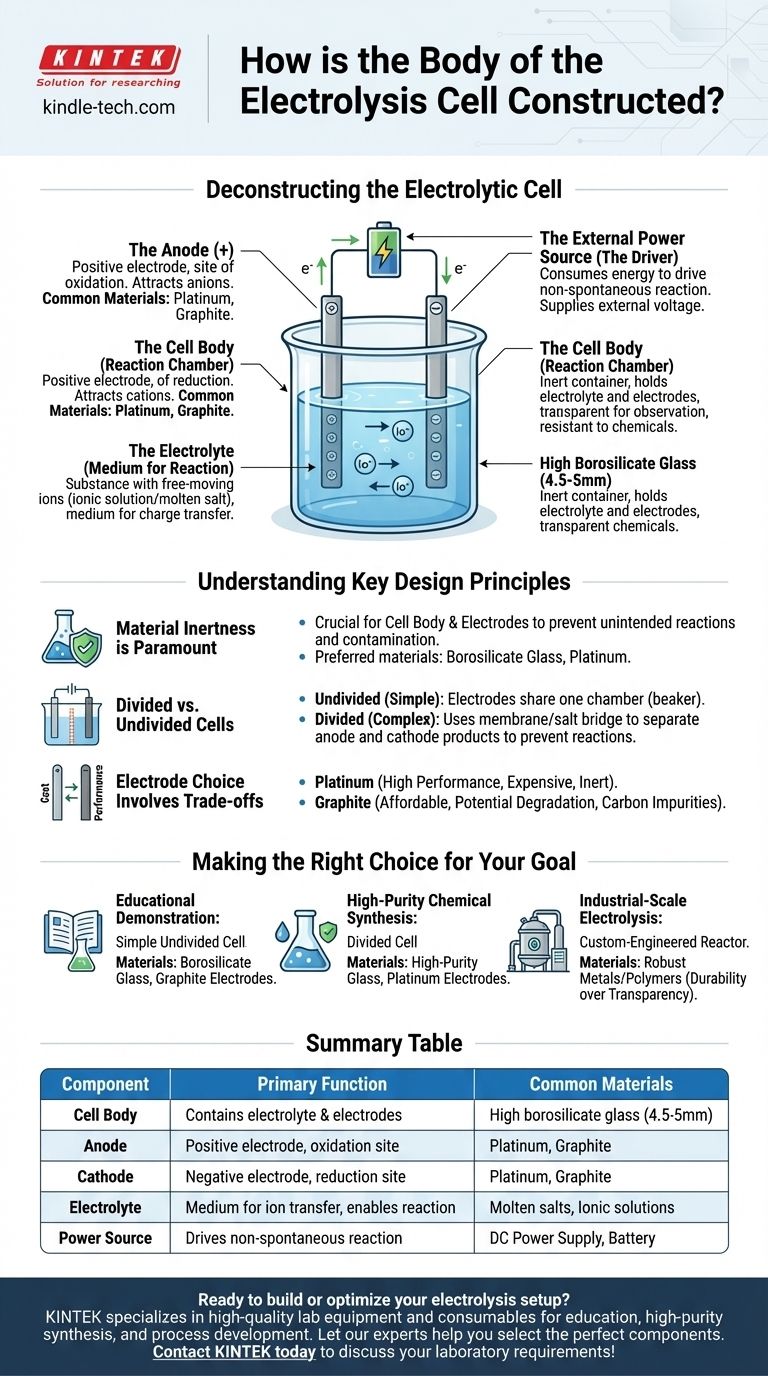
Para aplicações laboratoriais, o corpo de uma célula de eletrólise é tipicamente construído em vidro borossilicato de alta qualidade, muitas vezes com uma espessura de parede em torno de 4,5 a 5 mm. Este material é escolhido pela sua inércia química e resistência térmica. O recipiente físico, no entanto, é apenas uma parte de um sistema maior projetado para impulsionar uma reação química usando eletricidade.
O corpo da célula é simplesmente um recipiente inerte. A verdadeira função de uma célula eletrolítica é definida pelos seus três componentes internos principais: dois eletrodos (ânodo e cátodo), um eletrólito contendo íons móveis e uma fonte de energia externa para impulsionar a reação.

Desconstruindo a Célula Eletrolítica
Para entender a construção da célula, você deve olhar além do recipiente físico e analisar os componentes funcionais que ele abriga. Uma célula eletrolítica é um sistema completo onde cada parte desempenha um papel crítico no processo de eletrólise.
O Corpo da Célula (A Câmara de Reação)
A função principal do corpo é conter o eletrólito e manter os eletrodos no lugar sem interferir na reação química.
O vidro borossilicato de alta qualidade é um material comum porque é transparente, permitindo a observação, e altamente resistente à corrosão dos produtos químicos frequentemente agressivos usados como eletrólitos. Para aplicações específicas, outros materiais inertes, como certos polímeros, podem ser usados.
Os Eletrodos (O Ânodo e o Cátodo)
Os eletrodos são os condutores que introduzem energia elétrica no sistema. Uma célula eletrolítica sempre tem dois.
- O Ânodo é o eletrodo positivo. Ele atrai íons carregados negativamente (ânions) e é onde ocorre a oxidação.
- O Cátodo é o eletrodo negativo. Ele atrai íons carregados positivamente (cátions) e é onde ocorre a redução.
Estes são tipicamente feitos de materiais inertes, como platina ou grafite, que conduzem eletricidade bem, mas não participam prontamente da reação química em si.
O Eletrólito (O Meio para a Reação)
O eletrólito é a substância que contém íons livres e preenche o corpo da célula. É o meio através do qual a carga é transferida entre os eletrodos.
Os eletrólitos podem ser um composto iônico dissolvido em um solvente (como sal em água) ou um composto iônico fundido (como cloreto de sódio fundido). Os íons específicos dentro do eletrólito são aqueles que serão oxidados ou reduzidos durante a eletrólise.
A Fonte de Energia Externa (O Impulsionador)
Ao contrário de uma bateria que produz energia, uma célula eletrolítica consome energia para forçar a ocorrência de uma reação não espontânea.
Essa energia é fornecida por uma fonte de energia externa, como uma bateria ou uma fonte de alimentação CC, que é conectada ao ânodo e ao cátodo. Essa tensão externa é o que empurra os elétrons através do circuito e impulsiona os íons para seus respectivos eletrodos.
Compreendendo os Princípios Chave de Design
A construção de uma célula eletrolítica é guiada por princípios fundamentais que garantem seu funcionamento adequado. O mal-entendido desses princípios pode levar a experimentos fracassados ou processos ineficientes.
A Inércia do Material é Primordial
O princípio mais importante para o corpo da célula e os eletrodos é a inércia química. O recipiente e os condutores elétricos não devem reagir com o eletrólito. Qualquer reação não intencional pode contaminar os produtos e perturbar o processo eletroquímico desejado. É por isso que materiais especializados como vidro borossilicato e platina são preferidos em relação ao vidro comum ou metais reativos.
Células Divididas vs. Não Divididas
O design de célula mais simples é uma célula "não dividida", onde ambos os eletrodos compartilham um eletrólito comum em uma única câmara, como um béquer.
No entanto, às vezes os produtos formados no ânodo e no cátodo podem reagir entre si. Nesses casos, é usada uma célula "dividida". Este design incorpora uma membrana porosa ou uma ponte salina para separar a célula em duas meias-células distintas, mantendo os produtos isolados enquanto ainda permite o fluxo de íons entre os compartimentos.
A Escolha do Eletrodo Envolve Compensações
Embora ambos sejam comuns, a escolha entre eletrodos de platina e grafite envolve uma clássica compensação entre custo e desempenho.
A Platina é extremamente inerte e eficiente, mas muito cara. O Grafite é um condutor muito mais acessível, mas pode se degradar ou reagir sob certas condições, especialmente em altas tensões ou com eletrólitos específicos, introduzindo potencialmente impurezas de carbono no sistema.
Fazendo a Escolha Certa para o Seu Objetivo
A construção ideal de uma célula eletrolítica depende inteiramente de sua aplicação pretendida.
- Se o seu foco principal for demonstração educacional: Um béquer simples e não dividido feito de vidro borossilicato com eletrodos de grafite baratos é perfeitamente suficiente e econômico.
- Se o seu foco principal for síntese química de alta pureza: Uma célula dividida feita de vidro de alta pureza com eletrodos de platina estáveis e inertes é essencial para evitar a contaminação do produto e reações secundárias.
- Se o seu foco principal for eletrólise em escala industrial: A célula será um reator altamente especializado e projetado sob medida, muitas vezes construído a partir de metais ou polímeros robustos projetados para durabilidade, eficiência e operação contínua, em vez de transparência.
Compreender esses componentes centrais e suas funções permite que você selecione ou projete uma célula que corresponda precisamente ao seu objetivo.
Tabela de Resumo:
| Componente | Função Principal | Materiais Comuns |
|---|---|---|
| Corpo da Célula | Contém o eletrólito e os eletrodos | Vidro borossilicato de alta qualidade (4,5-5mm) |
| Ânodo | Eletrodo positivo; local de oxidação | Platina, Grafite |
| Cátodo | Eletrodo negativo; local de redução | Platina, Grafite |
| Eletrólito | Meio para transferência de íons; possibilita a reação | Sais fundidos, Soluções iônicas |
| Fonte de Energia | Impulsiona a reação não espontânea | Fonte de Alimentação CC, Bateria |
Pronto para construir ou otimizar seu setup de eletrólise? A construção correta da célula é fundamental para o sucesso do seu laboratório, seja para educação, síntese de alta pureza ou desenvolvimento de processos. A KINTEK é especializada em fornecer os equipamentos de laboratório e consumíveis de alta qualidade que você precisa — desde vidrarias duráveis de borossilicato até eletrodos inertes de platina e grafite. Deixe que nossos especialistas ajudem você a selecionar os componentes perfeitos para sua aplicação específica. Entre em contato com a KINTEK hoje mesmo para discutir suas necessidades laboratoriais!
Guia Visual
Produtos relacionados
- Célula Eletrolítica de Banho de Água de Cinco Portas de Camada Dupla
- Célula Eletroquímica Eletrolítica de Quartzo para Experimentos Eletroquímicos
- Célula Eletrolítica Eletroquímica Óptica de Dupla Camada Tipo H com Banho de Água
- Células Eletrolíticas PEM Personalizáveis para Diversas Aplicações de Pesquisa
- Célula Eletroquímica Eletrolítica de Banho de Água de Dupla Camada
As pessoas também perguntam
- Qual é o sistema experimental típico usado com uma célula eletrolítica de banho de água de dupla camada? Alcance Controle Eletroquímico Preciso
- Quais são as principais características de uma célula eletrolítica de banho-maria de dupla camada? Obtenha Controle Preciso de Temperatura para Seus Experimentos
- Quando é necessário reparo profissional para uma célula eletrolítica de banho-maria de dupla camada? Proteja a Precisão e a Segurança do Seu Laboratório
- Quais são os procedimentos após o uso de uma célula eletrolítica de banho-maria de dupla camada? Garanta a Longevidade do Equipamento e a Precisão dos Dados
- Quais são os volumes típicos e as configurações de abertura para uma célula eletrolítica de banho-maria de dupla camada? Otimize sua Configuração Eletroquímica



















