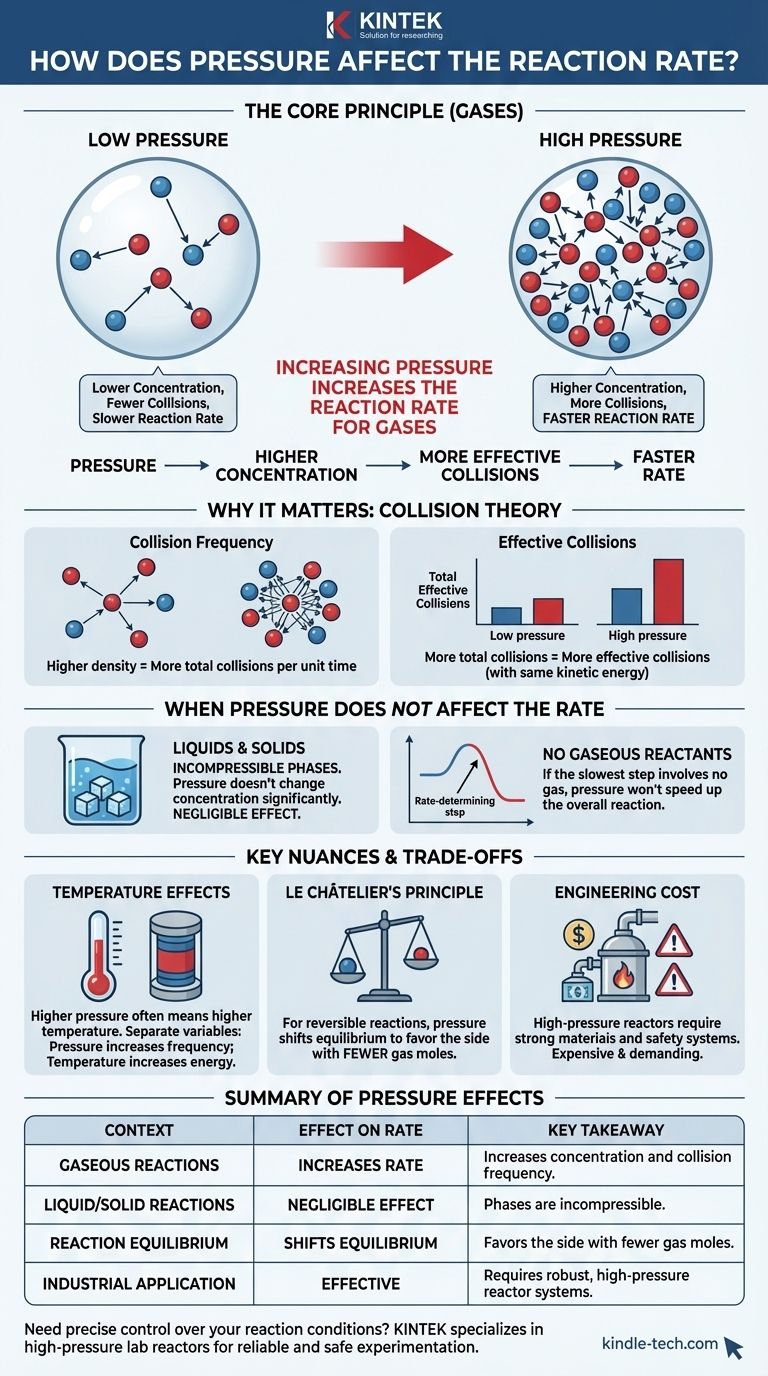
Em resumo, aumentar a pressão de uma reação envolvendo gases aumenta a velocidade da reação. Isso ocorre porque a pressão é uma medida direta da concentração para gases. Ao comprimir as moléculas de gás em um volume menor, você aumenta a probabilidade de elas colidirem e reagirem umas com as outras.
O princípio central é que, para reações gasosas, a pressão atua como uma alavanca direta na concentração. Uma pressão mais alta força as moléculas de gás a se aproximarem, aumentando a frequência de colisões eficazes e, assim, acelerando a reação. Este efeito é desprezível para reações na fase líquida ou sólida.

O Mecanismo Fundamental: Por que a Pressão Importa
Para realmente entender o efeito da pressão, precisamos voltar aos primeiros princípios de como as reações químicas acontecem. Tudo gira em torno do conceito de colisão de partículas.
Pressão como Medida de Concentração
Para gases, a pressão não é uma força abstrata; é o resultado das moléculas de gás colidindo com as paredes de seu recipiente.
A Lei dos Gases Ideais mostra uma relação direta entre pressão (P) e o número de moles (n) em um dado volume (V) a uma temperatura constante (T). Mais moléculas no mesmo espaço significam mais pressão. Portanto, aumentar a pressão é funcionalmente o mesmo que aumentar a concentração.
O Papel da Teoria das Colisões
As reações químicas ocorrem quando as partículas dos reagentes colidem com duas condições principais atendidas:
- Elas devem ter energia cinética suficiente para superar a barreira de energia de ativação.
- Elas devem colidir com a orientação física correta.
Uma colisão que atende a ambos os critérios é chamada de colisão eficaz. A velocidade de uma reação é determinada pela frequência dessas colisões eficazes.
Mais Pressão = Mais Colisões
Quando você aumenta a pressão de um sistema gasoso, você está forçando o mesmo número de moléculas para um volume menor.
Esta densidade mais alta significa que a distância média entre as moléculas diminui. Consequentemente, o número total de colisões entre as moléculas reagentes por unidade de tempo aumenta significativamente.
O Impacto nas Colisões "Eficazes"
Embora o aumento da pressão aumente o número total de colisões, ele não altera a energia cinética das moléculas individuais (assumindo que a temperatura seja constante).
Portanto, a porcentagem de colisões que são eficazes permanece a mesma. No entanto, como o número total de colisões aumentou, o número absoluto de colisões eficazes por segundo também aumenta. É isso que eleva a velocidade da reação.
Quando a Pressão Não Afeta a Velocidade
A ligação entre pressão e velocidade de reação é poderosa, mas não é universal. É fundamental saber quando ela não se aplica.
Reações em Fases Líquidas e Sólidas
Líquidos e sólidos são considerados fases incompressíveis. A aplicação de pressão externa não altera significativamente seu volume ou o espaçamento entre suas partículas constituintes.
Como as mudanças de pressão não alteram a concentração dos reagentes em líquidos e sólidos, a pressão tem um efeito desprezível nas velocidades das reações que ocorrem exclusivamente nessas fases.
Reações Sem Reagentes Gasosos
Se um mecanismo de reação envolve várias etapas, a velocidade geral é determinada pela etapa mais lenta, conhecida como etapa determinante da velocidade.
Se esta etapa determinante da velocidade não envolver reagentes gasosos, as mudanças na pressão externa não influenciarão a velocidade geral da reação.
Compreendendo as Vantagens e Nuances
Controlar a pressão é uma estratégia industrial comum, mas vem com considerações importantes que vão além das simples mudanças de velocidade.
Distinguindo dos Efeitos da Temperatura
Na prática, comprimir um gás aumenta sua temperatura. Tanto a pressão mais alta quanto a temperatura mais alta aumentam as velocidades de reação, mas por razões diferentes.
É crucial isolar as variáveis. A pressão aumenta a frequência das colisões, enquanto a temperatura aumenta a energia e a força dessas colisões, tornando uma porcentagem maior delas eficazes.
Princípio de Le Châtelier e Equilíbrio
Para reações reversíveis que atingem um estado de equilíbrio, a pressão desempenha um papel duplo. De acordo com o Princípio de Le Châtelier, o aumento da pressão deslocará a posição de equilíbrio para favorecer o lado da reação com menos moles de gás.
Este é um conceito separado da cinética (velocidade). A pressão aumenta a velocidade de ambas as reações direta e inversa, mas pode alterar o balanço final de produtos e reagentes.
O Custo de Engenharia da Alta Pressão
Construir e manter reatores de alta pressão é tecnologicamente exigente e caro. Os materiais devem ser fortes o suficiente para suportar o estresse, e sistemas de segurança extensivos são necessários para evitar falhas catastróficas. Este compromisso econômico e de segurança é um fator importante no projeto de processos industriais.
Aplicando Isso ao Seu Objetivo
Sua abordagem ao usar a pressão depende inteiramente do sistema químico com o qual você está trabalhando e do que você está tentando alcançar.
- Se seu foco principal é maximizar a velocidade de reação para um processo gasoso: Aumentar a pressão é um método direto e eficaz, desde que você possa gerenciar as mudanças de temperatura e os custos de engenharia associados.
- Se você está estudando o equilíbrio químico: Lembre-se de que a pressão afeta tanto as velocidades de reação quanto a posição final de equilíbrio, favorecendo o lado com menos moléculas de gás.
- Se sua reação envolve apenas líquidos ou sólidos: Mudar a pressão externa não é uma estratégia viável para controlar a velocidade da reação; concentre-se na temperatura, concentração ou catalisadores.
Ao entender a ligação direta da pressão com a concentração, você obtém uma poderosa alavanca para controlar a cinética das reações gasosas.
Tabela Resumo:
| Efeito da Pressão na Velocidade da Reação | Principal Conclusão |
|---|---|
| Reações Gasosas | Aumenta a velocidade ao aumentar a concentração e a frequência de colisões. |
| Reações Líquidas/Sólidas | Efeito desprezível; as fases são incompressíveis. |
| Equilíbrio da Reação | Desloca o equilíbrio para favorecer o lado com menos moles de gás. |
| Aplicação Industrial | Eficaz, mas requer sistemas de reatores robustos e de alta pressão. |
Precisa de controle preciso sobre suas condições de reação? A KINTEK é especializada em reatores de laboratório de alta pressão e equipamentos projetados para experimentação confiável e segura. Seja otimizando a velocidade de uma reação gasosa ou estudando o equilíbrio químico, nossas soluções oferecem o desempenho e a segurança que você precisa. Entre em contato com nossos especialistas hoje para encontrar o sistema perfeito para os desafios exclusivos do seu laboratório.
Guia Visual
Produtos relacionados
- Reatores de Alta Pressão Personalizáveis para Aplicações Científicas e Industriais Avançadas
- Reator Autoclavado de Alta Pressão em Aço Inoxidável Reator de Pressão Laboratorial
- Mini Reator Autoclave de Alta Pressão SS para Uso em Laboratório
- Fornalha de Tubo a Vácuo de Alta Pressão de Laboratório
- Reator Autoclave de Laboratório de Alta Pressão para Síntese Hidrotermal
As pessoas também perguntam
- Qual papel um autoclave desempenha na simulação das condições de PWR? Validação Avançada de Materiais para Segurança Nuclear
- Por que os autoclaves de alta pressão são essenciais para a preparação de agentes de cura de poliamida de base biológica a partir de ácido dimérico?
- Como um reator de alta pressão demonstra seu valor no envelhecimento acelerado? Preveja a durabilidade do catalisador rapidamente
- Qual é o propósito de usar um reator hidrotermal de alta temperatura? Melhorar a Síntese de Cátodos de Iodo@Carvão Ativado
- Qual é o papel dos reatores de alta pressão no estudo da oxidação de ligas? Ferramentas Essenciais para Pesquisa Supercrítica



















