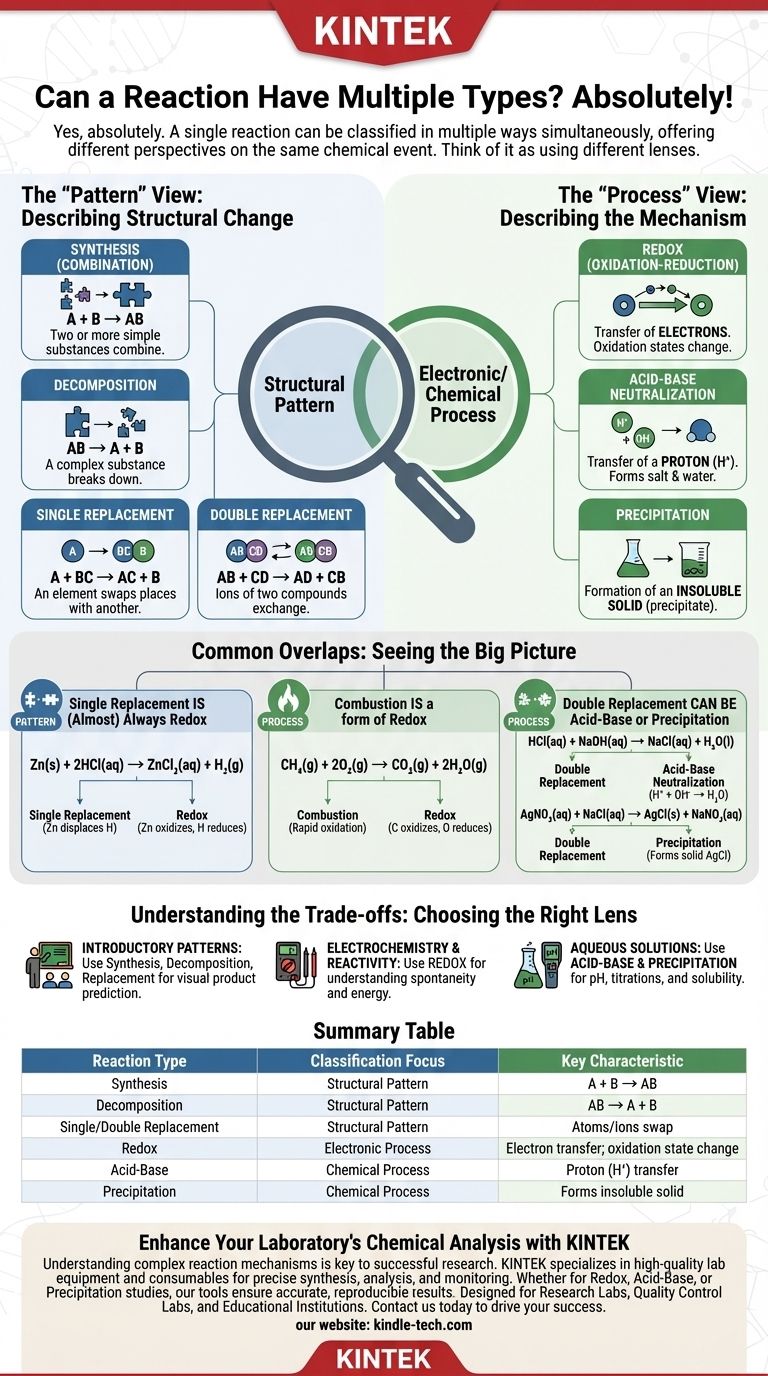
Sim, absolutamente. Uma única reação química pode frequentemente ser classificada como múltiplos tipos de reação simultaneamente. Este é um ponto comum de confusão porque a química introdutória muitas vezes apresenta os tipos de reação como categorias mutuamente exclusivas, mas uma compreensão mais avançada revela que são simplesmente lentes diferentes para analisar o mesmo evento químico.
A chave é entender que alguns tipos de reação descrevem o padrão estrutural de como os átomos se rearranjam (como síntese ou decomposição), enquanto outros descrevem o processo eletrônico ou químico subjacente (como redox ou ácido-base). Uma única reação pode exibir tanto um padrão específico quanto um processo específico.

Por Que Rótulos Simples Não São Suficientes
A forma como classificamos as reações depende do que queremos entender sobre elas. As categorias simples aprendidas primeiro são úteis para reconhecer padrões visuais, mas nem sempre explicam a mudança química fundamental.
A Visão de "Padrão": Descrevendo a Mudança Estrutural
No início de sua educação em química, você aprende a reconhecer reações pela forma como os reagentes formam produtos. Essas categorias descrevem a "forma" geral da transformação.
Os principais tipos baseados em padrão são:
- Síntese (ou Combinação): Duas ou mais substâncias simples se combinam para formar um produto mais complexo (
A + B → AB). - Decomposição: Uma substância complexa se decompõe em substâncias mais simples (
AB → A + B). - Substituição Simples: Um elemento troca de lugar com outro em um composto (
A + BC → AC + B). - Substituição Dupla: Os íons de dois compostos trocam de lugar para formar dois novos compostos (
AB + CD → AD + CB).
Esses rótulos são excelentes para prever rapidamente produtos com base em um padrão familiar.
A Visão de "Processo": Descrevendo o Mecanismo
Classificações mais sofisticadas descrevem como a transformação ocorre em nível molecular ou eletrônico. Elas se concentram no processo fundamental que impulsiona a reação.
Os principais tipos baseados em processo incluem:
- Redox (Oxirredução): Este tipo envolve a transferência de elétrons. Os estados de oxidação de um ou mais elementos mudam durante a reação.
- Neutralização Ácido-Base: Um ácido e uma base reagem, tipicamente envolvendo a transferência de um próton (íon H⁺) para formar um sal e água.
- Precipitação: Duas soluções aquosas são misturadas, e um sólido insolúvel (um precipitado) é formado.
Esses rótulos são essenciais para entender as forças motrizes subjacentes de uma reação.
Sobreposições Comuns Que Você Encontrará
Ver como essas categorias se sobrepõem é a melhor maneira de solidificar sua compreensão. A maioria das reações que você encontrará terá mais de um rótulo válido.
Substituição Simples é (Quase) Sempre Redox
Considere a reação do metal zinco com ácido clorídrico:
Zn(s) + 2HCl(aq) → ZnCl₂(aq) + H₂(g)
Esta é uma reação clássica de substituição simples porque o zinco desloca o hidrogênio. No entanto, também é uma reação de redox porque os estados de oxidação mudam: o zinco é oxidado (0 para +2) e o hidrogênio é reduzido (+1 para 0).
Combustão é uma forma de Redox
A combustão do metano é um bom exemplo:
CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(g)
Embora chamemos isso de combustão, é também fundamentalmente uma reação de redox. O carbono é oxidado (-4 para +4) e o oxigênio é reduzido (0 para -2).
Substituição Dupla pode ser Ácido-Base ou Precipitação
Considere a neutralização do ácido clorídrico com hidróxido de sódio:
HCl(aq) + NaOH(aq) → NaCl(aq) + H₂O(l)
Esta é uma reação de substituição dupla; Na⁺ e H⁺ trocam de lugar. Mais importante, é o exemplo definitivo de uma neutralização ácido-base.
Da mesma forma, misturando nitrato de prata e cloreto de sódio:
AgNO₃(aq) + NaCl(aq) → AgCl(s) + NaNO₃(aq)
Isso se encaixa no padrão de substituição dupla, mas sua característica mais notável é a formação de um sólido, tornando-a uma reação de precipitação.
Compreendendo as Trocas: O Propósito da Classificação
Escolher um rótulo não é encontrar a resposta "correta". É usar o rótulo mais descritivo e útil para seu objetivo específico.
A Limitação dos Padrões Simples
Classificar uma reação como "substituição simples" diz o que aconteceu com os átomos, mas não explica por que aconteceu. Não explica por que o zinco reage com HCl, mas o cobre não.
O Poder dos Rótulos Mecanicistas
Identificar a mesma reação como "redox" fornece uma visão muito mais profunda. Permite usar conceitos como série de atividade ou potenciais de eletrodo padrão para prever se a reação ocorrerá espontaneamente e para quantificar a energia envolvida. O rótulo redox explica o "porquê".
Fazendo a Escolha Certa para Seu Objetivo
Use a classificação que melhor atende ao seu propósito. O objetivo não é encontrar um rótulo único e exclusivo, mas aplicar o mais relevante.
- Se seu foco principal é reconhecer padrões básicos em um curso introdutório: Mantenha-se na síntese, decomposição e substituição simples/dupla para prever produtos visualmente.
- Se seu foco principal é eletroquímica ou previsão de reatividade: A classificação redox é a lente mais importante a ser usada.
- Se seu foco principal é trabalhar com soluções aquosas, pH e titulações: Classificar as reações como ácido-base ou precipitação será a abordagem mais útil.
Em última análise, usar o rótulo certo depende da pergunta específica que você está tentando responder sobre a transformação química.
Tabela Resumo:
| Tipo de Reação | Foco da Classificação | Característica Chave |
|---|---|---|
| Síntese | Padrão Estrutural | Dois ou mais reagentes se combinam em um produto (A + B → AB) |
| Decomposição | Padrão Estrutural | Um composto se decompõe em substâncias mais simples (AB → A + B) |
| Substituição Simples/Dupla | Padrão Estrutural | Átomos ou íons trocam de lugar entre compostos |
| Redox | Processo Eletrônico | Envolve transferência de elétrons; estados de oxidação mudam |
| Ácido-Base | Processo Químico | Envolve transferência de prótons (H⁺) |
| Precipitação | Processo Químico | Formação de um sólido insolúvel a partir de soluções aquosas |
Aprimore a Análise Química do Seu Laboratório com a KINTEK
Compreender mecanismos de reação complexos é fundamental para o sucesso da pesquisa e desenvolvimento. Na KINTEK, somos especializados em fornecer equipamentos e consumíveis de laboratório de alta qualidade que suportam síntese química precisa, análise e monitoramento de processos. Quer você esteja trabalhando em reações redox, titulações ácido-base ou estudos de precipitação, nossas ferramentas confiáveis ajudam você a alcançar resultados precisos e reproduzíveis.
Nossos produtos são projetados para:
- Laboratórios de Pesquisa que exigem controle preciso de temperatura para reações de síntese e decomposição.
- Laboratórios de Controle de Qualidade que necessitam de equipamentos consistentes para análises ácido-base e de precipitação.
- Instituições de Ensino que buscam aparelhos duráveis e fáceis de usar para o ensino de tipos de reação fundamentais e avançados.
Deixe a KINTEK ser sua parceira de confiança no avanço das capacidades do seu laboratório. Entre em contato conosco hoje para discutir suas necessidades específicas e descobrir como nossas soluções podem impulsionar seu sucesso.
Guia Visual
Produtos relacionados
- Célula de Gás de Eletrólise Eletroquímica Eletrolítica Célula de Reação de Fluxo Líquido
- Reator Autoclavado de Alta Pressão em Aço Inoxidável Reator de Pressão Laboratorial
- Reatores de Alta Pressão Personalizáveis para Aplicações Científicas e Industriais Avançadas
- Circulador de Aquecimento de Temperatura Constante de Alta Temperatura Banho de Água Resfriador Circulador para Banho de Reação
- Moedor Híbrido de Tecidos Laboratorial
As pessoas também perguntam
- Qual é o propósito da estrutura de dupla camada na célula eletrolítica tipo H? Alcançar Controle Térmico Preciso
- Quais vantagens as células eletrolíticas de fluxo oferecem em relação às células tipo H? Otimizar a Eficiência da Eletrólise de CO2
- Qual é a precaução em relação à temperatura ao usar uma célula eletrolítica totalmente em PTFE? Dicas Essenciais de Segurança Térmica
- Quais são as funções primárias de uma célula eletrolítica de alto desempenho no processo eCO2R? Otimize os resultados do seu laboratório
- Qual o papel de um reator eletroquímico de dois eletrodos no crescimento de TiO2? Alcance Nanostructures Ordenadas Hoje






