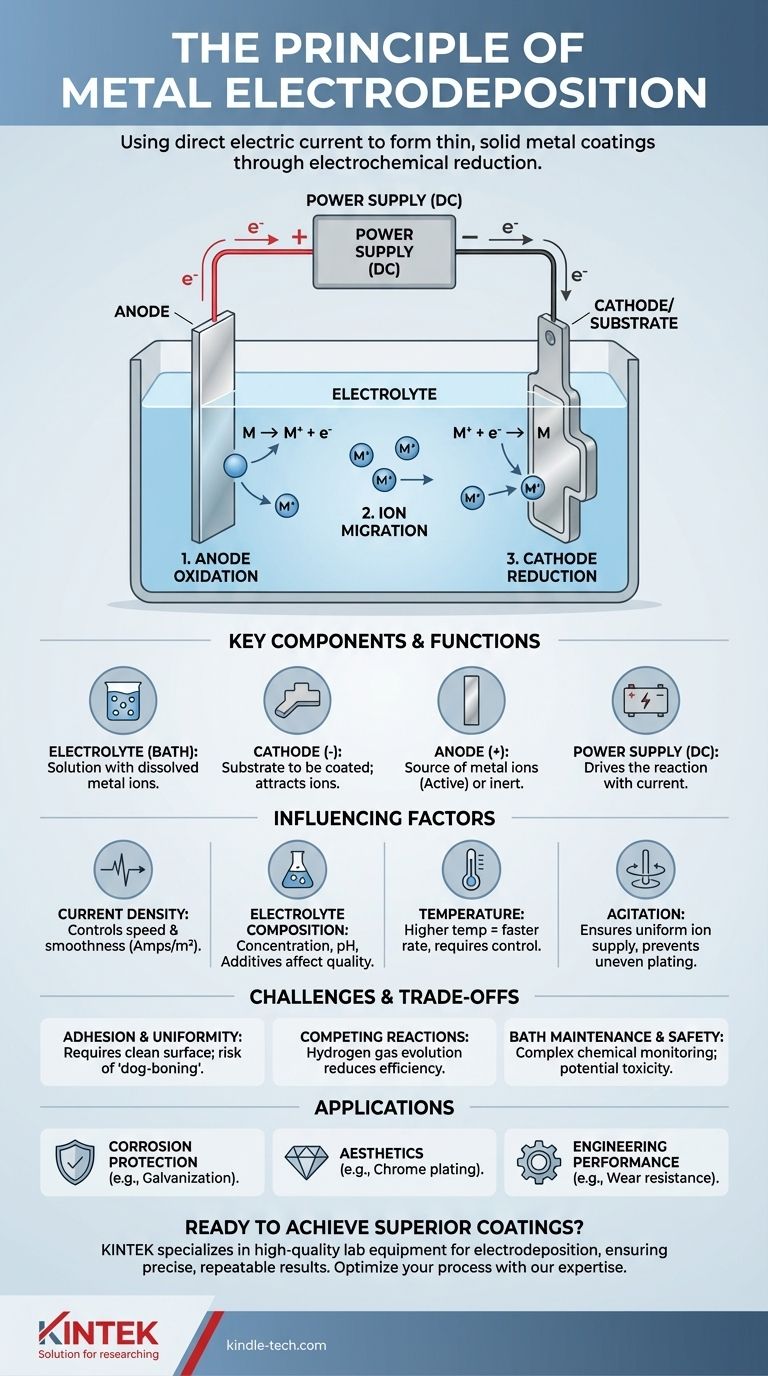
Em sua essência, o princípio da eletrodeposição é o processo de usar uma corrente elétrica contínua para reduzir íons metálicos dissolvidos de uma solução e formar um revestimento metálico fino e sólido sobre um objeto condutor. Essa reação eletroquímica controlada permite "banhar" um metal sobre outro, alterando fundamentalmente as propriedades da superfície do material base.
Todo o processo depende da criação de um circuito eletrolítico. Neste circuito, a eletricidade impulsiona uma reação química não espontânea, forçando os íons metálicos carregados positivamente em um banho líquido a aceitar elétrons e depositar-se como uma camada metálica neutra em uma superfície alvo.
Os Componentes Essenciais de um Sistema de Eletrodeposição
Para entender o princípio na prática, você deve primeiro compreender seus quatro componentes essenciais trabalhando juntos dentro de uma célula eletrolítica.
O Eletrólito (O Banho)
O eletrólito é uma solução contendo uma alta concentração dos íons metálicos que você deseja depositar. Isso é tipicamente feito dissolvendo sais metálicos (como sulfato de cobre ou cloreto de níquel) em água. O banho também contém outros aditivos para controlar a qualidade do revestimento final.
O Cátodo (O Substrato)
O cátodo é o objeto que você pretende revestir. Ele é conectado ao terminal negativo da fonte de alimentação. Essa carga negativa atrai os íons metálicos carregados positivamente do eletrólito.
O Ânodo (A Fonte de Metal)
O ânodo é conectado ao terminal positivo da fonte de alimentação. Pode ser de um de dois tipos:
- Ânodo Ativo: Feito do mesmo metal que está sendo depositado. Ele se dissolve lentamente, repondo os íons metálicos no eletrólito à medida que são depositados no cátodo.
- Ânodo Inerte: Feito de um material não reativo (como platina ou carbono). Não se dissolve, mas serve para completar o circuito elétrico. Neste caso, os íons metálicos no banho são esgotados ao longo do tempo.
A Fonte de Alimentação
Uma fonte de alimentação de corrente contínua (CC) atua como o motor para todo o processo. Ela fornece o potencial elétrico necessário para impulsionar os elétrons para o cátodo e puxá-los do ânodo, forçando a ocorrência da reação de deposição.
O Processo Eletroquímico, Passo a Passo
O processo de deposição é um ciclo contínuo de oxidação e redução impulsionado pela fonte de alimentação externa.
Passo 1: Oxidação no Ânodo
No ânodo positivo, ocorre uma reação de oxidação. Se o ânodo for ativo, seus átomos de metal perdem elétrons e se tornam íons carregados positivamente, dissolvendo-se no eletrólito. Isso mantém o suprimento de íons metálicos consistente.
Passo 2: Migração de Íons no Eletrólito
Os íons metálicos carregados positivamente (cátions) presentes no eletrólito são atraídos através da solução em direção ao cátodo carregado negativamente. Simultaneamente, os íons negativos (ânions) se movem em direção ao ânodo positivo, mantendo a solução eletricamente neutra.
Passo 3: Redução no Cátodo
Este é o passo de deposição. Quando os íons metálicos atingem o cátodo, eles ganham elétrons fornecidos pela fonte de energia. Esta reação de redução neutraliza sua carga, fazendo com que precipitem da solução e se liguem à superfície como átomos de metal sólido, construindo a camada de revestimento camada por camada.
Fatores Chave que Influenciam a Qualidade da Deposição
A qualidade, espessura e aparência do revestimento final não são automáticas. Elas dependem do controle cuidadoso de várias variáveis chave.
Densidade de Corrente
Esta é a quantidade de corrente por unidade de área de superfície do cátodo (medida em ampères/m²).
- Baixa densidade de corrente resulta em um revestimento lento, mas frequentemente mais suave e uniforme.
- Alta densidade de corrente acelera a deposição, mas pode levar a depósitos ásperos, porosos ou queimados se não for gerenciada corretamente.
Composição do Eletrólito
A concentração de íons metálicos, o nível de pH e a presença de aditivos (como abrilhantadores e niveladores) têm um impacto enorme. Esses aditivos podem alterar a estrutura cristalina do metal depositado, mudando seu acabamento de opaco para brilhante como um espelho.
Temperatura
Temperaturas de banho mais altas geralmente aumentam a condutividade do eletrólito e a taxa de deposição. No entanto, temperaturas excessivamente altas podem causar reações secundárias indesejadas ou decomposição de aditivos.
Agitação
Agitar ou de outra forma movimentar o banho é crítico. Isso garante um suprimento fresco de íons metálicos atingindo a superfície do cátodo, prevenindo o esgotamento localizado que causa revestimento irregular, especialmente em formas complexas.
Compreendendo as Compensações e Desafios
Embora poderosa, a eletrodeposição é um processo preciso com pontos de falha comuns.
Adesão e Uniformidade do Revestimento
O fator mais crítico para o sucesso é a preparação do substrato. Uma superfície suja ou oxidada resultará em baixa adesão, fazendo com que o revestimento descasque ou lasque. Além disso, a corrente elétrica se concentra naturalmente em bordas e cantos afiados, levando a depósitos mais espessos ali e depósitos mais finos em reentrâncias — um problema conhecido como efeito "osso de cachorro".
Reações Concorrentes
A principal reação concorrente, especialmente em eletrólitos aquosos, é a redução da água para produzir gás hidrogênio no cátodo. Este processo consome corrente elétrica que de outra forma seria usada para deposição de metal, reduzindo a eficiência geral. Em alguns casos, o hidrogênio absorvido também pode tornar o substrato quebradiço.
Manutenção e Segurança do Banho
Os banhos de eletrodeposição são sistemas químicos complexos que exigem monitoramento e ajuste constantes de pH, temperatura e concentrações químicas. Muitas soluções de galvanoplastia industrial, como as que contêm cianeto ou cromo hexavalente, são altamente tóxicas e representam riscos significativos para o meio ambiente e a segurança do operador.
Fazendo a Escolha Certa para Sua Aplicação
Compreender o princípio central permite adaptar o processo ao seu objetivo específico.
- Se o seu foco principal é a proteção contra corrosão: Seu objetivo é uma camada densa e não porosa, frequentemente usando um metal de sacrifício como zinco em aço (galvanização) ou um metal nobre como ouro.
- Se o seu foco principal é a estética: Você deve controlar cuidadosamente a densidade de corrente e usar aditivos específicos como abrilhantadores para obter uma superfície lisa e reflexiva, como visto com cromo ou niquelagem.
- Se o seu foco principal é o desempenho de engenharia (por exemplo, resistência ao desgaste): Você precisa de controle preciso sobre a espessura e dureza, frequentemente alcançado com cromo duro ou revestimentos de níquel químico, onde a forte adesão é primordial.
Ao controlar o fluxo de íons e elétrons, você pode transformar a superfície de um material para atender a uma necessidade específica de engenharia ou estética.

Tabela Resumo:
| Componente Chave | Função na Eletrodeposição |
|---|---|
| Eletrólito (Banho) | Solução contendo íons metálicos dissolvidos a serem depositados. |
| Cátodo (Substrato) | O objeto a ser revestido; atrai íons metálicos positivos. |
| Ânodo (Fonte de Metal) | Fonte de íons metálicos (ativo) ou eletrodo inerte. |
| Fonte de Alimentação (CC) | Fornece a corrente para impulsionar a reação não espontânea. |
| Densidade de Corrente | Controla a velocidade de deposição e a qualidade do revestimento (suavidade). |
| Aditivos de Banho | Influenciam as propriedades finais do revestimento (por exemplo, brilho, dureza). |
Pronto para Obter Revestimentos Metálicos Superiores em Seu Laboratório?
Compreender os princípios da eletrodeposição é o primeiro passo. Implementá-lo de forma eficaz requer o equipamento e os consumíveis certos. A KINTEK é especializada em equipamentos de laboratório de alta qualidade para eletrodeposição e outros processos de engenharia de superfície, ajudando você a alcançar resultados precisos, confiáveis e repetíveis.
Seja você focado em pesquisa, controle de qualidade ou desenvolvimento de novos revestimentos, nossa experiência pode apoiar as necessidades do seu laboratório.
Entre em contato com nossos especialistas hoje para discutir como podemos ajudá-lo a otimizar seu processo de eletrodeposição!
Guia Visual
Produtos relacionados
- Crisol e Barco de Evaporação de Cobre Livre de Oxigênio para Revestimento por Evaporação de Feixe de Elétrons
- Forno de Tubo CVD Versátil Feito Sob Medida para Equipamentos de Sistema de Deposição Química em Fase de Vapor
- Máquina de Montagem de Amostras Metalográficas para Materiais e Análises de Laboratório
- Máquina Elétrica de Prensagem de Comprimidos de Punção Única Laboratório Puncionamento de Comprimidos TDP Prensa de Comprimidos
- Células Eletrolíticas PEM Personalizáveis para Diversas Aplicações de Pesquisa
As pessoas também perguntam
- Posso soldar cobre com cobre sem fluxo? O Papel Crítico do Fluxo para uma Ligação Forte
- Qual a espessura do revestimento por pulverização catódica para SEM? Obtenha Imagens e Análises Ótimas
- O que é revestimento por feixe de elétrons? Um Guia para Filmes Finos PVD de Alto Desempenho
- Quais são os dois métodos que podem ser usados para prevenir a corrosão de um metal? Proteção por Barreira vs. Proteção Sacrificial Explicada
- O que é uma máquina de sputtering por magnetron? Deposição de Filmes Finos de Precisão para Materiais Avançados



















