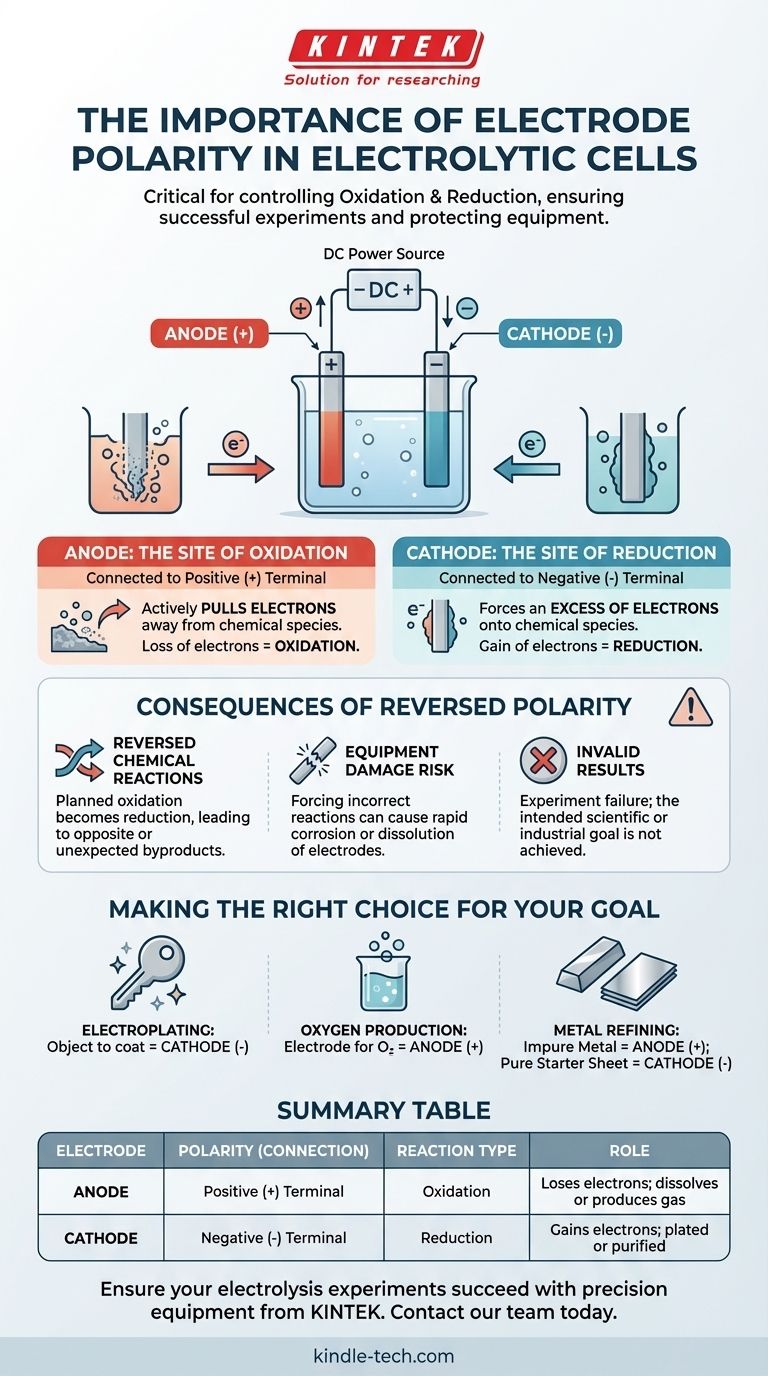
Em uma célula eletrolítica, a polaridade correta do eletrodo é crítica porque ela dita onde ocorrem as reações químicas fundamentais de oxidação e redução. O terminal positivo da fonte de energia define o ânodo (o local da oxidação), e o terminal negativo define o cátodo (o local da redução). Inverter essas conexões reverterá a transformação química pretendida, levando a falha experimental e potencial dano ao equipamento.
O princípio central é este: a polaridade do eletrodo não é um rótulo arbitrário, mas o mecanismo de controle direto para sua reação química. Ela determina qual eletrodo perde elétrons (oxidação) e qual ganha (redução), controlando assim quais substâncias são formadas ou consumidas.

Os Papéis Fundamentais do Ânodo e do Cátodo
Para entender a importância da polaridade, devemos primeiro definir os papéis dos dois eletrodos em um processo eletrolítico. Esses papéis são impulsionados inteiramente por sua conexão a uma fonte de energia externa.
O Ânodo: O Local da Oxidação
O ânodo é o eletrodo conectado ao terminal positivo (+) da fonte de alimentação.
Essa conexão positiva puxa ativamente os elétrons das espécies químicas na solução eletrolítica que estão próximas à superfície do ânodo. Essa perda forçada de elétrons é chamada de oxidação.
O Cátodo: O Local da Redução
O cátodo é o eletrodo conectado ao terminal negativo (-) da fonte de alimentação.
Essa conexão negativa cria um excesso de elétrons na superfície do cátodo. Esses elétrons são então forçados sobre as espécies químicas na solução, fazendo com que elas ganhem elétrons. Esse processo é chamado de redução.
A Fonte de Energia: A Força Motriz
Ao contrário de uma bateria padrão (uma célula galvânica) que produz energia a partir de uma reação espontânea, uma célula eletrolítica usa energia para impulsionar uma reação não espontânea.
A fonte de energia externa atua como uma bomba de elétrons. Ela os puxa do ânodo e os empurra para o cátodo, forçando uma mudança química que não aconteceria por si só.
Compreendendo as Consequências da Polaridade Invertida
Conectar os eletrodos aos terminais errados não é um erro menor; ele altera fundamentalmente todo o experimento. Isso é frequentemente referido como "inverter a polaridade".
Você Inverte as Reações Químicas
Se você inverter as conexões, o eletrodo que você pretendia que fosse o ânodo se torna o cátodo, e vice-versa.
A reação química que você planejou para o ânodo (oxidação) não acontecerá. Em vez disso, uma reação de redução ocorrerá lá. Isso significa que seu experimento produzirá o oposto dos resultados pretendidos, ou criará subprodutos totalmente inesperados.
Você Corre o Risco de Danificar Seu Equipamento
Forçar uma reação em um material errado pode ter consequências destrutivas. Por exemplo, se você estiver fazendo eletrodeposição, inverter a polaridade começará a dissolver o objeto que você pretendia revestir.
Em alguns casos, tentar oxidar um eletrodo que não foi projetado para isso pode fazer com que ele corroa rapidamente. Isso pode contaminar sua solução e danificar permanentemente o eletrodo.
Seus Resultados Serão Inválidos
Em última análise, a polaridade invertida invalida o experimento. Se você estiver tentando revestir uma camada de cobre em uma chave, inverter a configuração fará com que a fonte de cobre seja revestida com metal da chave, dissolvendo efetivamente a chave. O resultado é a falha em atingir o objetivo científico ou industrial.
Fazendo a Escolha Certa para Seu Objetivo
Atribuir a polaridade corretamente é como você comanda o resultado químico. Antes de conectar sua fonte de energia, confirme qual eletrodo deve ser o ânodo (+) e qual deve ser o cátodo (-).
- Se seu foco principal é a eletrodeposição de um objeto: O objeto que você deseja revestir deve ser o cátodo (-), pois é onde os íons metálicos positivos serão reduzidos a uma camada de metal sólido.
- Se seu foco principal é a produção de gás oxigênio a partir da água: O eletrodo onde você deseja que o oxigênio se forme deve ser o ânodo (+), pois é onde as moléculas de água são oxidadas.
- Se seu foco principal é refinar metal impuro: O bloco de metal impuro deve ser o ânodo (+) para que possa ser oxidado e dissolver-se na solução, enquanto uma chapa de partida pura deve ser o cátodo (-) para coletar o metal recém-purificado.
Dominar a polaridade do eletrodo lhe dá controle direto sobre as reações eletroquímicas que você deseja realizar.
Tabela Resumo:
| Eletrodo | Polaridade (Conexão) | Tipo de Reação | Função |
|---|---|---|---|
| Ânodo | Terminal Positivo (+) | Oxidação | Perde elétrons; alvo se dissolve ou produz gás (ex: O₂) |
| Cátodo | Terminal Negativo (-) | Redução | Ganha elétrons; alvo é revestido ou purificado |
Garanta o sucesso de seus experimentos de eletrólise com equipamentos de precisão da KINTEK.
Seja para refinar metais, eletrodepositar ou conduzir pesquisas, nossos equipamentos e consumíveis de laboratório especializados são projetados para precisão e durabilidade. Nossos especialistas podem ajudá-lo a selecionar as fontes de energia e eletrodos certos para controlar perfeitamente suas reações químicas.
Não arrisque resultados inválidos ou equipamentos danificados—entre em contato com nossa equipe hoje para discutir suas necessidades específicas de laboratório.
Guia Visual
Produtos relacionados
- Célula Eletroquímica Eletrolítica de Quartzo para Experimentos Eletroquímicos
- Célula Eletrolítica Eletroquímica Óptica de Dupla Camada Tipo H com Banho de Água
- Célula Eletrolítica Eletroquímica para Avaliação de Revestimentos
- Células Eletrolíticas PEM Personalizáveis para Diversas Aplicações de Pesquisa
- Célula de Fluxo de Redução de CO2 Personalizável para Pesquisa em NRR, ORR e CO2RR
As pessoas também perguntam
- Qual é o procedimento adequado para a limpeza pós-experimento e armazenamento de uma célula eletrolítica totalmente em quartzo? Garanta a Longevidade e a Reprodutibilidade
- Que precauções devem ser tomadas ao manusear e usar uma célula eletrolítica de quartzo puro? Garanta um Desempenho Seguro, Preciso e Durável
- Quais são as etapas necessárias para preparar uma célula eletrolítica totalmente de quartzo antes de um experimento? Garanta precisão e segurança
- Quais são os procedimentos operacionais e as precauções de segurança durante um experimento usando uma célula eletrolítica totalmente em quartzo? Garanta Segurança e Precisão no Seu Laboratório
- Quais são as principais aplicações da célula eletrolítica totalmente de quartzo? Essencial para Análise de Alta Pureza e Óptica



















