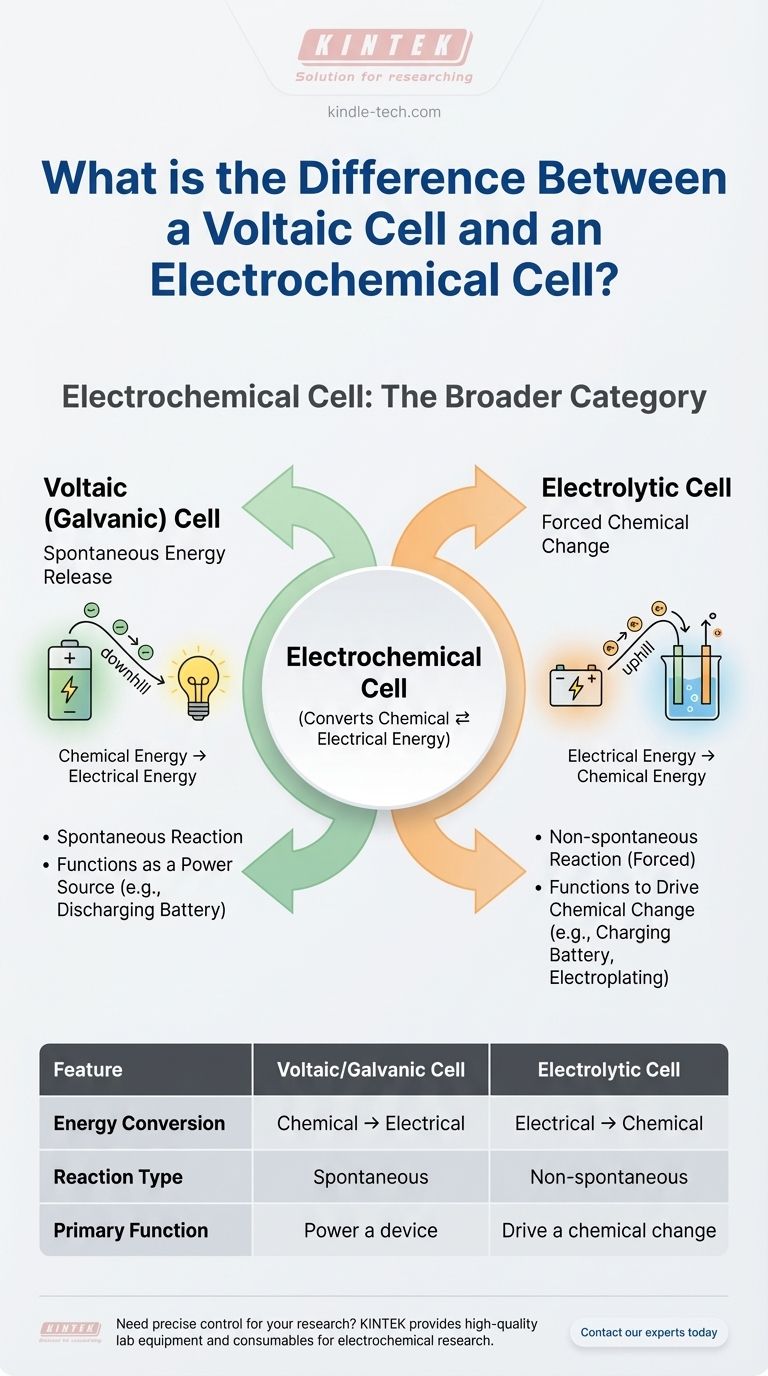
Para ser direto, uma célula voltaica não é diferente de uma célula eletroquímica — é um tipo de célula eletroquímica. O termo "célula eletroquímica" é a categoria ampla para qualquer dispositivo que converte energia química em energia elétrica ou vice-versa. Uma célula voltaica, também conhecida como célula galvânica, é o tipo específico que gera eletricidade espontaneamente a partir de uma reação química.
O principal equívoco surge ao tratar esses termos como escolhas paralelas. Em vez disso, pense nisso como uma hierarquia: "Célula Eletroquímica" é o nome da família, e ela tem dois filhos: a Célula Voltaica (que produz energia) e a Célula Eletrolítica (que consome energia).

Os Dois Caminhos da Eletroquímica
Uma célula eletroquímica é fundamentalmente uma ponte entre os mundos químico e elétrico. Todas essas células compartilham componentes básicos — dois eletrodos (um ânodo e um cátodo) e um eletrólito que permite que os íons se movam entre eles.
A diferença crucial reside na direção da conversão de energia.
Tipo 1: A Célula Voltaica (Galvânica) — Liberação Espontânea de Energia
Uma célula voltaica aproveita uma reação química espontânea para produzir energia elétrica.
Pense nisso como um escorregador controlado. Os produtos químicos estão naturalmente "ladeira abaixo" em termos de energia, e a célula voltaica fornece um caminho para que essa energia seja liberada como uma corrente elétrica útil.
Este é o princípio por trás de uma bateria comum. As reações químicas dentro de uma bateria AA querem acontecer por si mesmas, e quando você completa o circuito, a célula canaliza o fluxo resultante de elétrons para alimentar seu dispositivo.
Tipo 2: A Célula Eletrolítica — Mudança Química Forçada
Uma célula eletrolítica faz exatamente o oposto. Ela usa uma fonte externa de energia elétrica para forçar uma reação química que não aconteceria por si mesma.
Este é o caminho "ladeira acima". Você está empurrando energia para o sistema para criar um estado químico menos estável.
Exemplos clássicos incluem o uso de eletricidade para eletrólise (como a divisão da água em hidrogênio e oxigênio) ou recarregar uma bateria. Quando você carrega seu telefone, você está fazendo com que sua bateria funcione como uma célula eletrolítica, revertendo as reações químicas que ocorreram quando ela estava alimentando seu dispositivo.
Compreendendo as Diferenças Críticas
A distinção entre esses dois tipos de células é o conceito mais importante na eletroquímica básica. A direção do fluxo de energia dita toda a função da célula.
Conversão de Energia
Uma célula voltaica converte energia química em energia elétrica. É uma fonte de energia.
Uma célula eletrolítica converte energia elétrica em energia química. É um consumidor de energia.
Espontaneidade da Reação
A reação redox em uma célula voltaica é espontânea. Ela acontece sem intervenção externa uma vez que o circuito é completado.
A reação redox em uma célula eletrolítica é não espontânea. Ela requer uma fonte de energia externa (como uma bateria ou fonte de alimentação DC) para ocorrer.
Função Prática
A função de uma célula voltaica é alimentar algo. Pense em qualquer bateria padrão não recarregável.
A função de uma célula eletrolítica é produzir uma mudança química. Pense em eletrodeposição de metal ou carregamento de uma bateria recarregável.
Como Classificar Sua Célula Corretamente
Para aplicar esse conhecimento, basta perguntar se a célula está produzindo energia ou consumindo-a para impulsionar uma reação.
- Se seu foco principal é descrever qualquer dispositivo que interconverte energia química e elétrica: Use o termo amplo célula eletroquímica.
- Se você está descrevendo especificamente uma bateria que está descarregando para alimentar um dispositivo: Use os termos específicos célula voltaica ou célula galvânica.
- Se você está descrevendo especificamente um processo que usa eletricidade para forçar uma reação (como carregar uma bateria ou eletrólise): Use o termo específico célula eletrolítica.
Ao compreender essa classificação simples, você pode descrever qualquer processo eletroquímico com precisão e clareza.
Tabela Resumo:
| Característica | Célula Voltaica/Galvânica | Célula Eletrolítica |
|---|---|---|
| Conversão de Energia | Química → Elétrica | Elétrica → Química |
| Tipo de Reação | Espontânea | Não espontânea (Forçada) |
| Função Primária | Alimentar um dispositivo (ex: bateria) | Impulsionar uma mudança química (ex: eletrodeposição) |
Precisa de controle preciso sobre seus processos eletroquímicos? A KINTEK é especializada em equipamentos de laboratório e consumíveis de alta qualidade para todas as suas necessidades de pesquisa e desenvolvimento eletroquímico. Quer você esteja trabalhando com células voltaicas, células eletrolíticas ou qualquer outra aplicação laboratorial, nossas soluções garantem precisão e confiabilidade. Entre em contato com nossos especialistas hoje para encontrar o equipamento perfeito para seu laboratório!
Guia Visual
Produtos relacionados
- Célula Eletrolítica Eletroquímica Óptica de Dupla Camada Tipo H com Banho de Água
- Célula Eletrolítica Eletroquímica para Avaliação de Revestimentos
- Célula Eletroquímica Eletrolítica de Quartzo para Experimentos Eletroquímicos
- Célula Eletrolítica Tipo H Tripla Eletroquímica
- Célula Eletrolítica de PTFE Célula Eletroquímica Resistente à Corrosão Selada e Não Selada
As pessoas também perguntam
- Como a célula espectroeletroquímica de camada fina deve ser manuseada para garantir sua longevidade? Dicas de Manutenção Especializada
- Como são utilizados potenciômetros ou galvanômetros de alta precisão na CGDE? Caracterização de Eletrólitos Mestre
- Qual é o mecanismo da célula eletrolítica dupla de Devanathan-Stachurski? Explore testes precisos de permeação de hidrogênio
- Quais são os propósitos de design do reator de aço inoxidável e da tampa de fluoroplástico? Garanta a Eletrólise de Alta Pureza
- Quais são as principais precauções de segurança a seguir durante a operação de uma célula eletrolítica tipo H? Orientações Essenciais para Experimentos Sem Risco
- Quais inspeções regulares são necessárias para uma célula eletrolítica de banho de água de cinco portas? Garanta Resultados Eletroquímicos Consistentes
- Quais são os passos para configurar e executar um experimento com a célula eletrolítica Raman in-situ?
- Como são definidas as funções do cátodo e do ânodo dentro de uma célula eletrolítica? Guia Especializado de Eletrólise



















