Descobertas históricas em eletroquímica
A experiência da rã de Galvani
Em 1791, o cientista italiano Luigi Galvani realizou uma experiência inovadora que ligaria para sempre a biologia e a eletroquímica. Durante a dissecação da perna de uma rã, Galvani reparou que a perna se contraía quando entrava em contacto com dois metais diferentes. Esta observação, aparentemente simples, conduziu a uma constatação profunda: os tecidos biológicos podiam gerar e responder a sinais eléctricos.
Esta descoberta não era apenas uma curiosidade académica, mas tinha também implicações práticas. O fenómeno observado por Galvani foi mais tarde designado por "ação galvânica" e lançou as bases para o desenvolvimento de dispositivos como o galvanómetro, um instrumento utilizado para medir pequenas correntes eléctricas. Além disso, o processo de galvanização - o revestimento de metais para evitar a corrosão - foi batizado em sua honra, sublinhando o impacto duradouro do seu trabalho.
A experiência de Galvani foi um momento crucial na história da ciência, fazendo a ponte entre as ciências da vida e as ciências físicas. Demonstrou que os sistemas biológicos podiam ser compreendidos através da lente dos princípios electroquímicos, abrindo caminho para futuros avanços em ambos os campos.
A invenção da pilha voltaica por Volta
Em 1799, Alessandro Volta, um físico italiano, fez uma descoberta inovadora que lançou as bases dos sistemas electroquímicos modernos. Ele inventou a primeira fonte de energia química, conhecida como pilha Voltaica, que era essencialmente uma pilha de discos de cobre e zinco separados por um pano húmido ou cartão embebido em salmoura. Este dispositivo simples, mas engenhoso, era capaz de gerar uma corrente eléctrica constante, marcando o início da produção prática de eletricidade.
A importância da invenção de Volta foi rapidamente percebida e estimulou novas investigações sobre as potenciais aplicações desta nova fonte de energia. Apenas um ano depois, em 1800, William Nicholson e Anthony Carlisle utilizaram uma pilha Voltaica para realizar a primeira eletrólise bem sucedida da água. Durante esta experiência, observaram a precipitação de gases, especificamente hidrogénio e oxigénio, o que confirmou a decomposição das moléculas de água nos seus elementos constituintes sob a influência de uma corrente eléctrica.
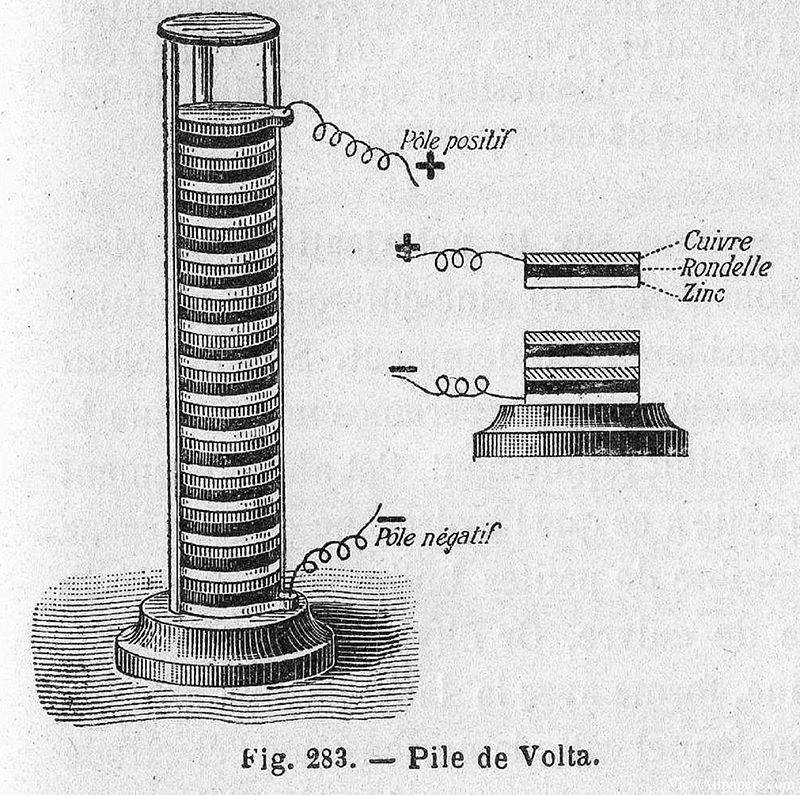
Esta descoberta não só validou o conceito de eletrólise, como também demonstrou a utilidade prática da pilha de Volta na experimentação científica. A capacidade de decompor compostos nas suas partes elementares utilizando eletricidade abriu novos caminhos para a investigação em química e física, preparando o caminho para futuros avanços na teoria e aplicações electroquímicas.
Sucessos da eletrólise
Em 1803, Humphry Davy alcançou um sucesso inovador no campo da eletroquímica ao isolar com sucesso os metais potássio e sódio através do processo de eletrólise. Esta descoberta monumental não só demonstrou o poder dos métodos electroquímicos, como também abriu caminho para a produção de monómeros de metais activos, que são essenciais em várias aplicações industriais.
As experiências de Davy envolveram a utilização de uma pilha voltaica, a primeira fonte de energia química inventada por Alessandro Volta. Ao fazer passar uma corrente eléctrica através de sais fundidos, Davy conseguiu decompor estes compostos e obter metais puros. Esta técnica marcou um avanço significativo na extração de metais reactivos, que anteriormente eram difíceis de isolar utilizando métodos químicos tradicionais.
As implicações do trabalho de Davy estenderam-se para além do laboratório. O seu sucesso na eletrólise lançou as bases para a investigação futura em processos electroquímicos, levando ao desenvolvimento de métodos mais eficientes para a extração e purificação de metais. Esta descoberta também sublinhou o potencial das técnicas electroquímicas em vários sectores industriais, desde a metalurgia ao fabrico de produtos químicos.
Além disso, as descobertas de Davy contribuíram para uma compreensão mais ampla dos princípios electroquímicos, preparando o terreno para avanços teóricos subsequentes, como a Lei de Faraday da Eletrólise e a Equação de Nernst. Estes quadros teóricos, por sua vez, permitiram estudos quantitativos mais precisos dos fenómenos electroquímicos, fazendo avançar ainda mais o campo.
Em resumo, a eletrólise bem sucedida do potássio e do sódio por Davy em 1803 foi um momento crucial na história da eletroquímica, demonstrando as aplicações práticas dos métodos electroquímicos e lançando as bases para futuras inovações neste campo.
Fundamentos teóricos da eletroquímica
Lei da Eletrólise de Faraday
Em 1834, Michael Faraday, um físico e químico pioneiro, formulou a lei da eletrólise, uma pedra angular no campo da eletroquímica. Esta lei forneceu um quadro quantitativo para a compreensão e análise dos fenómenos electroquímicos, fazendo avançar significativamente os fundamentos teóricos da disciplina. O trabalho de Faraday foi fundamental para colmatar a lacuna entre observações empíricas e modelos teóricos, lançando as bases para futuras descobertas e aplicações em eletroquímica.
A lei da eletrólise de Faraday é constituída por dois princípios fundamentais:
- Primeira Lei: A massa de uma substância depositada ou libertada num elétrodo durante a eletrólise é diretamente proporcional à quantidade de eletricidade passada através do eletrólito.
- Segunda Lei: A massa de uma substância depositada ou libertada num elétrodo durante a eletrólise é diretamente proporcional ao peso químico equivalente da substância.
Estas leis permitiram aos cientistas medir com precisão a quantidade de material transformado durante uma reação eletroquímica, facilitando o desenvolvimento de procedimentos e técnicas padronizados em eletroquímica. Ao quantificar a relação entre a corrente eléctrica, o tempo e as alterações químicas resultantes, as leis de Faraday forneceram um método robusto para estudar e prever processos electroquímicos.
O impacto do trabalho de Faraday estendeu-se para além da mera quantificação. As suas leis promoveram uma compreensão mais profunda dos mecanismos subjacentes à eletrólise, o que, por sua vez, levou a avanços em várias aplicações práticas. Estas aplicações iam desde processos industriais como a refinação de metais e a galvanoplastia até ao desenvolvimento de baterias e células de combustível, que são parte integrante dos sistemas energéticos modernos.
Além disso, as contribuições de Faraday prepararam o terreno para desenvolvimentos teóricos subsequentes em eletroquímica. As suas leis foram fundamentais para o trabalho de cientistas posteriores, como Walther Nernst, que deduziu a equação de Nernst, e Julius Tafel, que formulou a equação de Tafel. Estes avanços refinaram ainda mais a compreensão dos potenciais dos eléctrodos, da cinética das reacções e do comportamento dos iões em solução, que são aspectos críticos da investigação eletroquímica moderna.
Em suma, a lei de Faraday da eletrólise não só revolucionou o estudo quantitativo dos fenómenos electroquímicos, como também estabeleceu uma base teórica sólida para o campo emergente da eletroquímica. O seu trabalho continua a influenciar e a inspirar a investigação e aplicações contemporâneas, sublinhando o significado duradouro das suas contribuições para a ciência.
A equação de Nernst
Em 1889, o químico alemão Walther Nernst fez uma contribuição inovadora para o campo da eletroquímica ao derivar uma relação matemática que ligava o potencial do elétrodo à concentração de substâncias envolvidas na reação eletroquímica. Esta relação, agora conhecida como equação de Nernst, tornou-se uma pedra angular no estudo dos sistemas electroquímicos.
A equação de Nernst fornece um meio quantitativo para prever o potencial de uma célula eletroquímica em condições não padronizadas, o que é crucial para compreender e controlar os processos electroquímicos. É expressa como:
[ E = E^\circ - \frac{RT}{nF} \ln Q ]
onde:
- ( E ) é o potencial do elétrodo.
- ( E^\circ ) é o potencial de elétrodo padrão.
- ( R ) é a constante universal dos gases.
- ( T ) é a temperatura em Kelvin.
- ( n ) é o número de moles de electrões transferidos na reação.
- ( F ) é a constante de Faraday.
- ( Q ) é o quociente de reação.
A equação demonstra como as alterações na concentração podem influenciar o potencial de um elétrodo, o que é vital para aplicações que vão desde a conceção de baterias a processos industriais de eletrólise. Ao permitir que os cientistas prevejam e manipulem os potenciais dos eléctrodos, a equação de Nernst fez avançar significativamente a nossa capacidade de conceber e otimizar os sistemas electroquímicos.
Esta descoberta não foi apenas um triunfo teórico, mas também prático, uma vez que proporcionou aos cientistas e engenheiros uma ferramenta para melhor compreenderem e controlarem o comportamento das células electroquímicas sob várias condições. A equação de Nernst continua a ser uma parte indispensável da teoria e da prática electroquímicas, realçando o profundo impacto do trabalho de Nernst neste campo.
Equação de Tafel
Em 1905, Julius Tafel introduziu uma fórmula empírica inovadora que estabelecia uma relação direta entre a densidade da corrente e o sobrepotencial do hidrogénio. Esta equação, conhecida como Equação de Tafel, desempenhou um papel fundamental no avanço da nossa compreensão da cinética eletroquímica. O trabalho de Tafel foi fundamental para elucidar os mecanismos subjacentes à taxa de reacções electroquímicas, particularmente as que envolvem a evolução do hidrogénio.
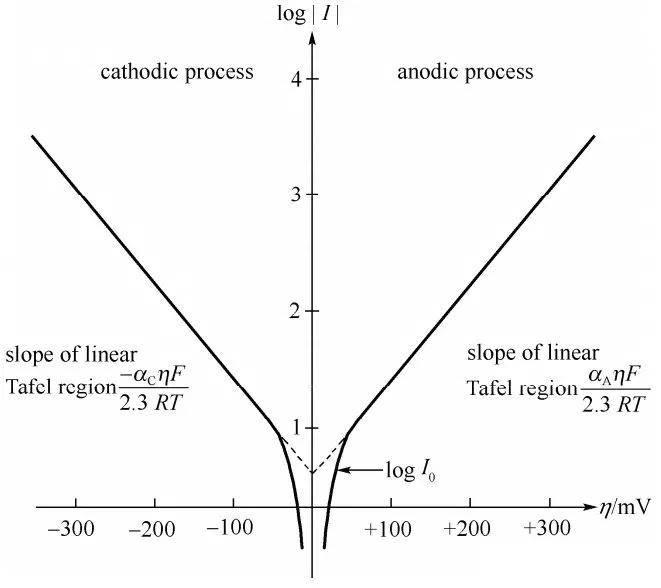
A equação de Tafel é normalmente expressa como:
$$ \eta = a + b \log(i) $$
onde:
- (\eta) é o sobrepotencial,
- (i) é a densidade da corrente,
- (a) e (b) são constantes específicas do material do elétrodo e das condições de reação.
A importância da equação de Tafel reside na sua capacidade de descrever quantitativamente a velocidade dos processos electroquímicos, o que é crucial para otimizar os materiais dos eléctrodos e as condições de reação. Esta lei empírica tem sido extensivamente validada e aplicada em vários sistemas electroquímicos, desde a investigação fundamental até às aplicações industriais.
| Parâmetro | Descrição |
|---|---|
| (\eta) | Sobrepotencial, a tensão adicional necessária para além do potencial de equilíbrio |
| (i) | Densidade da corrente, a corrente por unidade de área da superfície do elétrodo |
| (a) | Constante relacionada com a densidade da corrente de permuta e o fator de simetria |
| (b) | Inclinação de Tafel, relacionada com o coeficiente de transferência de carga |
O trabalho pioneiro de Tafel lançou as bases da investigação subsequente em cinética eletroquímica, influenciando o desenvolvimento de teorias e técnicas mais sofisticadas. A sua equação permanece uma pedra angular no campo, destacando a intrincada interação entre os processos eléctricos e químicos na eletroquímica.
Cinética e técnicas electroquímicas
A partir de 1940, o campo da eletroquímica interfacial conheceu avanços significativos, particularmente na compreensão da estrutura da dupla camada e na cinética da precipitação de hidrogénio. Estes desenvolvimentos lançaram as bases para teorias e técnicas mais sofisticadas em cinética eletroquímica. Uma das contribuições mais notáveis durante este período foi o estabelecimento da teoria microscópica da transferência de electrões de Marcus. Esta teoria forneceu um quadro detalhado para compreender como os electrões se movem através das interfaces, o que é crucial para muitos processos electroquímicos.
Os avanços na cinética eletroquímica não se limitaram a construções teóricas. As técnicas experimentais também evoluíram, permitindo aos investigadores sondar o comportamento dos electrões e iões nas interfaces com maior precisão. Por exemplo, o desenvolvimento de novos métodos espectroscópicos permitiu a observação em tempo real das reacções químicas que ocorrem nas superfícies dos eléctrodos. Estas técnicas têm sido fundamentais para validar e aperfeiçoar modelos teóricos, como a teoria de Marcus, fornecendo dados empíricos que podem ser diretamente comparados com previsões teóricas.
Além disso, a interação entre os avanços teóricos e experimentais conduziu ao desenvolvimento de sistemas electroquímicos mais eficientes. Por exemplo, a compreensão da cinética de precipitação do hidrogénio tem sido aplicada na conceção de melhores células de combustível e baterias, que são essenciais para as modernas tecnologias de armazenamento e conversão de energia. Estes sistemas beneficiam de uma cinética melhorada, que conduz a uma maior eficiência e a tempos de vida mais longos.
Em resumo, o período a partir de 1940 marcou uma era transformadora na cinética e nas técnicas electroquímicas. A sinergia entre os conhecimentos teóricos e as capacidades experimentais não só aprofundou a nossa compreensão dos processos fundamentais, como também abriu caminho a aplicações práticas nos domínios da energia e da ciência dos materiais.
Técnicas electroquímicas in situ
Desde a sua criação na década de 1970, as técnicas electroquímicas in situ revolucionaram a exploração dos mecanismos electroquímicos. Estas técnicas permitem que os investigadores observem e analisem processos electroquímicos diretamente nos seus ambientes operacionais, fornecendo conhecimentos sem paralelo sobre a dinâmica das reacções na interface elétrodo-eletrólito.
Um dos avanços mais significativos neste domínio é a integração da espetroscopia eletroquímica de absorção de raios X (XAS) in situ. Este método permite a monitorização em tempo real das alterações da estrutura eletrónica e dos estados de oxidação dos materiais durante as reacções electroquímicas. Ao combinar a XAS com técnicas electroquímicas, os cientistas podem correlacionar as transformações estruturais com o desempenho eletroquímico, aprofundando assim a nossa compreensão dos processos catalíticos e dos materiais dos eléctrodos.
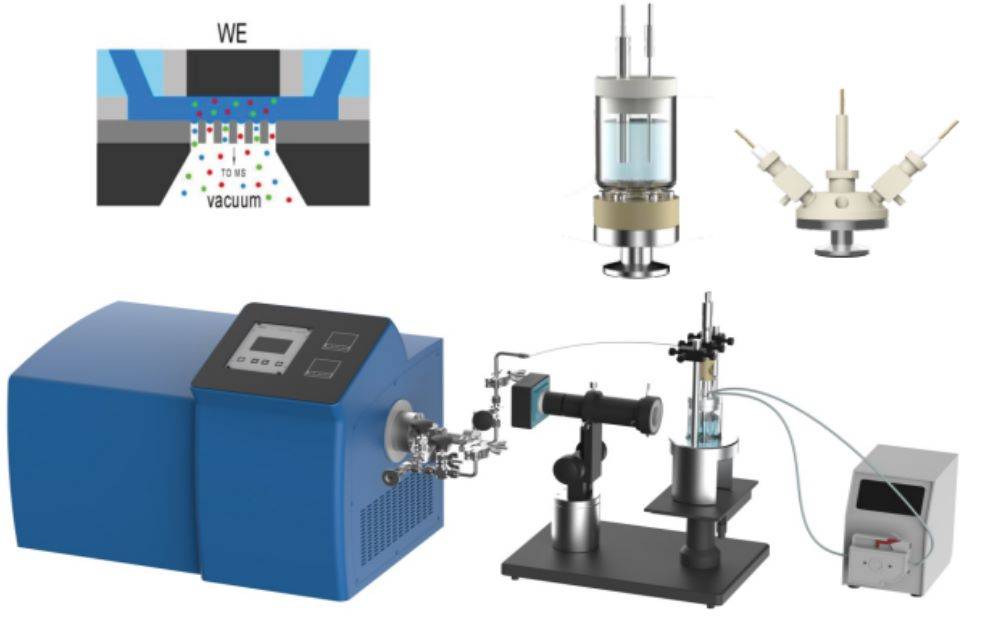
Para além da XAS, outras técnicas in situ, como a microscopia eletroquímica de varrimento (SECM) e a espetroscopia Raman in situ, ganharam também proeminência. A SECM permite a resolução espacial de processos electroquímicos à escala micrométrica, enquanto a espetroscopia Raman in situ fornece informações vibracionais pormenorizadas sobre as espécies envolvidas nas reacções.
A versatilidade e a precisão das técnicas electroquímicas in situ não só melhoraram a investigação fundamental como também aceleraram o desenvolvimento de aplicações práticas. Por exemplo, estas técnicas são fundamentais para otimizar o desempenho de baterias, células de combustível e electrocatalisadores. Ao fornecer dados em tempo real sobre os intermediários da reação e as modificações da superfície, os métodos in situ ajudam a conceber dispositivos electroquímicos mais eficientes e duradouros.
Além disso, a evolução contínua destas técnicas está a alargar a sua aplicabilidade. Os avanços na instrumentação e nos métodos de análise de dados estão a permitir uma maior resolução, uma aquisição de dados mais rápida e uma interpretação mais exacta dos resultados. Este progresso está a preparar o caminho para a próxima geração de investigação eletroquímica, em que as técnicas in situ desempenharão um papel fundamental na revelação das complexidades dos sistemas electroquímicos.
Direcções modernas em eletroquímica
Mecanismos electroquímicos microscópicos
A exploração de processos electroquímicos à escala atómica e molecular é um ponto fulcral da investigação contemporânea. Este campo emprega principalmente in situ e não in situ para dissecar os mecanismos intrincados que regem estes processos. Estas técnicas permitem que os investigadores observem e analisem as reacções electroquímicas à medida que estas ocorrem, fornecendo informações sem precedentes sobre a dinâmica em jogo.
Um dos principais avanços neste domínio é a utilização de espetroscopia eletroquímica de absorção de raios X (XAS) in situ . Este método permite a monitorização em tempo real das alterações na estrutura eletrónica e nos estados de oxidação dos materiais durante as reacções electroquímicas. Por exemplo, a XAS pode revelar a forma como a superfície de um catalisador se altera durante a catálise de uma reação específica, fornecendo pistas para otimizar o catalisador para um melhor desempenho.
Adicionalmente, microscopia de túnel de varrimento (STM) e microscopia de força atómica (AFM) têm sido fundamentais para visualizar a morfologia da superfície e as propriedades electrónicas dos eléctrodos a nível atómico. Estas técnicas têm sido cruciais para compreender como os defeitos da superfície, os adsorventes e outras caraterísticas microscópicas influenciam o comportamento eletroquímico dos materiais.
Para construir um mecanismo de reação abrangente e racional, os investigadores combinam frequentemente estas observações microscópicas com modelos teóricos. Por exemplo, teoria do funcional da densidade (DFT) podem prever as paisagens energéticas de potenciais vias de reação, enquanto a dinâmica molecular (MD) podem modelar o comportamento dependente do tempo de iões e moléculas no eletrólito.
A integração de abordagens experimentais e teóricas conduziu a avanços significativos neste domínio. Por exemplo, a conceção racional de electrocatalisadores para a separação da água e a redução do CO₂ tem sido orientada por conhecimentos obtidos a partir destes esforços combinados. Estes avanços não só melhoram a nossa compreensão fundamental dos processos electroquímicos, como também abrem caminho ao desenvolvimento de tecnologias energéticas mais eficientes e sustentáveis.
Em resumo, a utilização de técnicas avançadas in situ e não in situ, associada à modelização teórica, revolucionou o estudo dos mecanismos electroquímicos a nível microscópico. Esta abordagem interdisciplinar continua a impulsionar a inovação tanto na investigação académica como nas aplicações industriais.
Avanços nos ensaios electroquímicos
Os métodos electroquímicos tradicionais estão a passar por transformações significativas para satisfazer as exigências contemporâneas. Estes avanços são impulsionados pela necessidade de aumentar a sensibilidade da monitorização, adaptar-se a condições ambientais extremas e integrar tratamentos matemáticos sofisticados. A evolução das técnicas de ensaio eletroquímico não é apenas uma melhoria incremental, mas uma mudança de paradigma que preenche a lacuna entre a compreensão teórica e a aplicação prática.
Um dos principais domínios de desenvolvimento é a integração de modelos matemáticos avançados. Estes modelos permitem previsões e interpretações mais precisas dos fenómenos electroquímicos, particularmente em sistemas complexos em que os métodos tradicionais não são suficientes. Por exemplo, a incorporação de algoritmos de aprendizagem automática permitiu a análise e a otimização em tempo real dos processos electroquímicos, reduzindo significativamente o tempo e os recursos necessários para a experimentação.

Além disso, a adaptabilidade destes métodos a condições extremas abriu novas vias de investigação e aplicação. Quer se trate das altas temperaturas dos processos industriais ou das baixas temperaturas da exploração espacial, as técnicas electroquímicas modernas estão a ser adaptadas para funcionarem de forma fiável e eficiente. Esta adaptabilidade é crucial para indústrias que vão desde a produção de energia à ciência dos materiais, onde as condições podem variar muito.
Para além dos avanços matemáticos, os componentes de hardware dos ensaios electroquímicos também registaram melhorias notáveis. Sensores de alta precisão e sistemas automatizados são agora comuns, permitindo a monitorização contínua e a recolha de dados. Estes sistemas não são apenas mais precisos, mas também mais fáceis de utilizar, tornando os ensaios electroquímicos avançados acessíveis a uma gama mais vasta de investigadores e indústrias.
A sinergia entre estes avanços na modelação matemática, adaptabilidade ambiental e melhorias no hardware conduziu a uma nova era nos ensaios electroquímicos. Esta era é caracterizada por uma maior precisão, eficiência e aplicabilidade, abrindo caminho para avanços tanto na investigação fundamental como nas aplicações práticas.
Aplicações interdisciplinares
A versatilidade da eletroquímica é evidente nas suas vastas aplicações em vários domínios científicos e industriais. Uma das áreas de aplicação mais significativas é a electrossíntese que utiliza processos electroquímicos para sintetizar compostos orgânicos e inorgânicos complexos. Este método é particularmente útil na produção de produtos farmacêuticos, agroquímicos e especialidades químicas, oferecendo um controlo preciso das condições de reação e minimizando os resíduos.
Processos de eletrólise são outra pedra angular da eletroquímica moderna, desempenhando um papel crucial na produção de produtos químicos industriais essenciais, como o cloro e o hidróxido de sódio na indústria de cloro e álcalis. Além disso, a eletrólise é vital na extração de metais como o alumínio e na produção de hidrogénio através da eletrólise da água, que é fundamental para soluções energéticas sustentáveis.
Proteção contra a corrosão é uma aplicação crítica em que os princípios electroquímicos são utilizados para proteger os metais da degradação. Técnicas como a galvanoplastia, a proteção anódica sacrificial e a proteção anódica são amplamente utilizadas para prolongar a vida útil das estruturas metálicas em vários ambientes, desde ambientes marinhos a instalações industriais.
Electrocatálise representa um campo de vanguarda onde a eletroquímica se cruza com a catálise para aumentar a eficiência das reacções químicas. Isto é particularmente importante no desenvolvimento de células de combustível, que convertem energia química diretamente em energia eléctrica com elevada eficiência e um impacto ambiental mínimo.
No domínio das novas fontes de energia a eletroquímica está na vanguarda da investigação sobre tecnologias avançadas de baterias, incluindo baterias de iões de lítio e baterias de estado sólido. Estas tecnologias são essenciais para a transição para sistemas de energia renovável, oferecendo densidades de energia mais elevadas e períodos de vida mais longos em comparação com as baterias tradicionais.
Fotoelectroquímica funde a fotoquímica com a eletroquímica, utilizando a energia da luz para conduzir reacções electroquímicas. Este domínio é crucial para o desenvolvimento de células solares e da separação fotoelectroquímica da água, que pode converter a luz solar diretamente em hidrogénio, um combustível limpo e abundante.
Por último, bioelectroquímica é uma disciplina emergente que aplica princípios electroquímicos a sistemas biológicos. Isto inclui o desenvolvimento de biossensores para diagnóstico médico e bioelectrocatálise para bioremediação e produção de bioenergia. Estas aplicações realçam o profundo impacto da eletroquímica tanto na saúde humana como na sustentabilidade ambiental.
Aplicações práticas da eletroquímica
Eletrólise e Electrossíntese
A eletrólise e a electrossíntese são fundamentais na transformação de matérias-primas em produtos valiosos, impulsionando vários processos industriais. A indústria de cloro e álcalis é uma pedra angular, utilizando a eletrólise para produzir cloro e hidróxido de sódio, essenciais para vários processos químicos e sectores de produção. Este processo não só assegura um fornecimento constante destes produtos químicos, como também sublinha a eficiência e a escalabilidade dos métodos electroquímicos.
No domínio da eletrólise do alumínio o processo Hall-Héroult continua a ser indispensável. Este método, que envolve a redução electrolítica da alumina dissolvida em criolite fundida, é crucial para a indústria global de produção de alumínio. O aperfeiçoamento e a otimização contínuos deste processo reduziram significativamente o consumo de energia e o impacto ambiental, tornando-o um modelo de prática industrial sustentável.

A eletrólise da água tem atraído uma atenção significativa, particularmente no contexto do armazenamento de energias renováveis e da produção de hidrogénio. Ao dividir a água em hidrogénio e oxigénio utilizando uma corrente eléctrica, este processo oferece uma solução limpa e escalável para a produção de combustível de hidrogénio, que pode ser armazenado e utilizado para alimentar várias aplicações, desde os transportes aos processos industriais.
A electrossíntese alarga o âmbito das aplicações electroquímicas, permitindo a síntese de moléculas orgânicas complexas e de produtos farmacêuticos. Esta técnica permite um controlo preciso das condições de reação, conduzindo a maiores rendimentos e pureza dos produtos. A versatilidade da electrossíntese é exemplificada pela sua utilização na produção de produtos químicos finos, agroquímicos e materiais especializados, reforçando a sua importância no fabrico moderno de produtos químicos.
Estas aplicações realçam coletivamente o potencial transformador da eletrólise e da electrossíntese, impulsionando a inovação em várias indústrias e contribuindo para os objectivos de desenvolvimento sustentável.
Corrosão e proteção de metais
A corrosão de metais é um problema significativo em várias indústrias, levando a perdas económicas substanciais e a riscos de segurança. Para atenuar estes efeitos, foram desenvolvidos e implementados vários métodos avançados. Entre eles, galvanoplastia destaca-se como uma técnica versátil que não só melhora o aspeto estético dos metais, como também melhora significativamente a sua resistência à corrosão. Ao depositar uma fina camada de um metal mais resistente à corrosão sobre a superfície do metal de base, a galvanoplastia actua como uma barreira protetora contra os elementos ambientais.
Outro método eficaz é a proteção por ânodo de sacrifício que envolve a fixação de um metal mais reativo à estrutura que necessita de proteção. Este metal de sacrifício, muitas vezes feito de magnésio ou zinco, corrói preferencialmente, protegendo assim o metal subjacente da corrosão. Esta técnica é amplamente utilizada em ambientes marinhos, onde as taxas de corrosão são particularmente elevadas.
Proteção anódica é outra abordagem sofisticada que envolve a polarização de um metal para um potencial em que este se torna passivo, reduzindo significativamente a sua taxa de corrosão. Este método é particularmente eficaz para metais que podem formar uma camada de óxido estável, como o aço inoxidável. Ao controlar o potencial, a proteção anódica pode prolongar a vida útil de infra-estruturas críticas em indústrias como o processamento químico e a refinação de petróleo.
Estes métodos, juntamente com outros como a proteção catódica e tecnologias de revestimento formam coletivamente um arsenal robusto contra a corrosão dos metais, garantindo a longevidade e a fiabilidade das estruturas metálicas em diversas aplicações.
Bioelectroquímica
A bioelectroquímica representa uma intersecção fascinante entre a biologia e a eletroquímica, com aplicações que vão desde o diagnóstico médico à monitorização ambiental. Uma das aplicações mais proeminentes é o desenvolvimento de biosensores que utilizam moléculas biológicas para detetar e quantificar substâncias específicas. Estes sensores são fundamentais no diagnóstico médico, permitindo a deteção rápida e precisa de biomarcadores, hormonas e agentes patogénicos. Por exemplo, os biossensores de glucose são amplamente utilizados na gestão da diabetes, permitindo a monitorização em tempo real dos níveis de glucose no sangue.
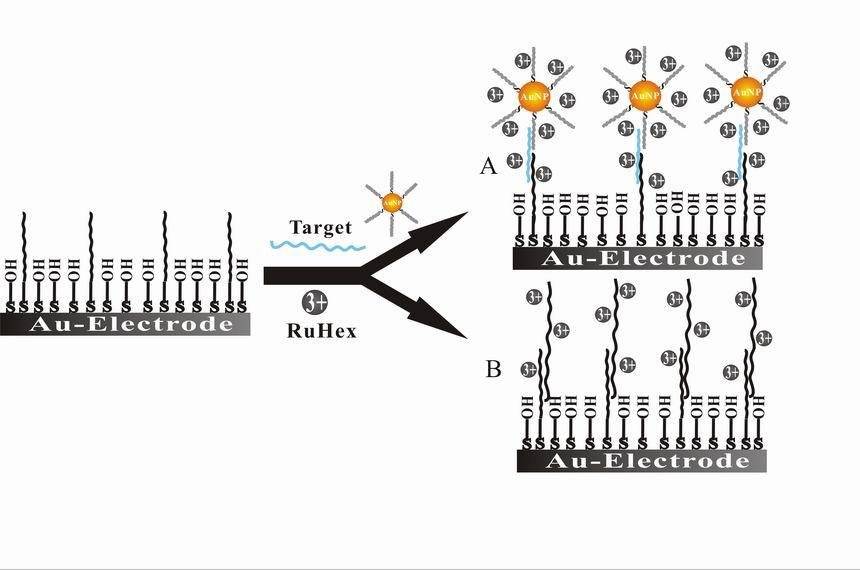
Para além dos biossensores, bioelectrocatálise é outra área crítica da bioelectroquímica. Este campo centra-se na utilização de enzimas ou microorganismos como catalisadores em reacções electroquímicas, aumentando a eficiência e a especificidade destes processos. A bioelectrocatálise tem implicações significativas nas energias renováveis, no tratamento de resíduos e nos processos industriais. Por exemplo, as células de combustível microbianas utilizam a bioelectrocatálise para converter resíduos orgânicos diretamente em eletricidade, oferecendo uma solução sustentável para a produção de energia e a gestão de resíduos.
| Aplicação | Descrição da aplicação | Exemplo |
|---|---|---|
| Biossensores | Utilizam moléculas biológicas para deteção e quantificação | Biossensores de glucose para controlo da diabetes |
| Bioelectrocatálise | Utilizar enzimas ou microorganismos como catalisadores em reacções electroquímicas | Células de combustível microbianas para produção de energia a partir de resíduos orgânicos |
A sinergia entre princípios biológicos e electroquímicos na bioelectroquímica continua a impulsionar a inovação, prometendo novas ferramentas e métodos tanto para a investigação científica como para aplicações práticas.
Fontes de alimentação químicas
As fontes de energia química englobam um conjunto diversificado de tecnologias, cada uma com caraterísticas e aplicações únicas. As categorias principais incluem pilhas primárias, pilhas secundárias, pilhas de iões de lítio e células de combustível. As pilhas primárias, como as pilhas alcalinas e de zinco-carbono, são concebidas para utilização única e encontram-se normalmente em dispositivos do dia a dia, como controlos remotos e lanternas. As baterias secundárias, ou recarregáveis, incluem as baterias de chumbo-ácido e de hidreto metálico de níquel, que podem ser recarregadas várias vezes, o que as torna ideais para aplicações que requerem energia sustentada durante períodos prolongados.
As baterias de iões de lítio revolucionaram a eletrónica portátil e os veículos eléctricos devido à sua elevada densidade energética, longa vida útil e baixas taxas de auto-descarga. Estas baterias são compostas por compostos de lítio como eléctrodos e um eletrólito não aquoso, oferecendo um equilíbrio entre custo, desempenho e impacto ambiental.
As células de combustível, por outro lado, representam um avanço significativo na tecnologia de energia sustentável. Ao contrário das baterias, que armazenam energia quimicamente, as células de combustível geram eletricidade através da reação eletroquímica de um combustível, normalmente o hidrogénio, com um oxidante, normalmente o oxigénio. Este processo resulta numa elevada eficiência, baixa poluição e a capacidade de ajustar a produção de energia com base na procura. As pilhas de combustível são particularmente promissoras para aplicações como veículos eléctricos, sistemas de energia de reserva e até mesmo para a exploração espacial, onde a energia fiável e limpa é fundamental.
| Tipo de bateria | Casos de uso primário | Vantagens chave |
|---|---|---|
| Baterias primárias | Dispositivos de utilização única (controlos remotos, lanternas) | Económicas, amplamente disponíveis |
| Pilhas secundárias | Dispositivos recarregáveis (telemóveis, computadores portáteis) | Reutilizáveis, longa duração |
| Pilhas de iões de lítio | Eletrónica portátil, veículos eléctricos | Elevada densidade energética, baixa auto-descarga |
| Células de combustível | Veículos eléctricos, energia de reserva, espaço | Elevada eficiência, baixa poluição, escalável |
Produtos relacionados
- Potenciostato de Estação de Trabalho Eletroquímico para Uso Laboratorial
- Eletrodo de Disco de Ouro
- Eletrodo de Ouro Eletroquímico em Folha de Ouro
- Suporte de Eletrodo para Experimentos Eletroquímicos
- Célula Eletrolítica Tipo H Tripla Eletroquímica
Artigos relacionados
- Guia completo de analisadores de solo portáteis: Características, benefícios e aplicações
- Compreender os eléctrodos de referência de calomelano saturado: Composição, usos e considerações
- Revolucionar o controlo de qualidade: O Guia Definitivo para Analisadores Portáteis de Baterias de Lítio
- Explorando o banho de água da célula electrolítica multifuncional: Aplicações e benefícios
- Guia completo para eléctrodos de referência: Tipos, aplicações e critérios de seleção













