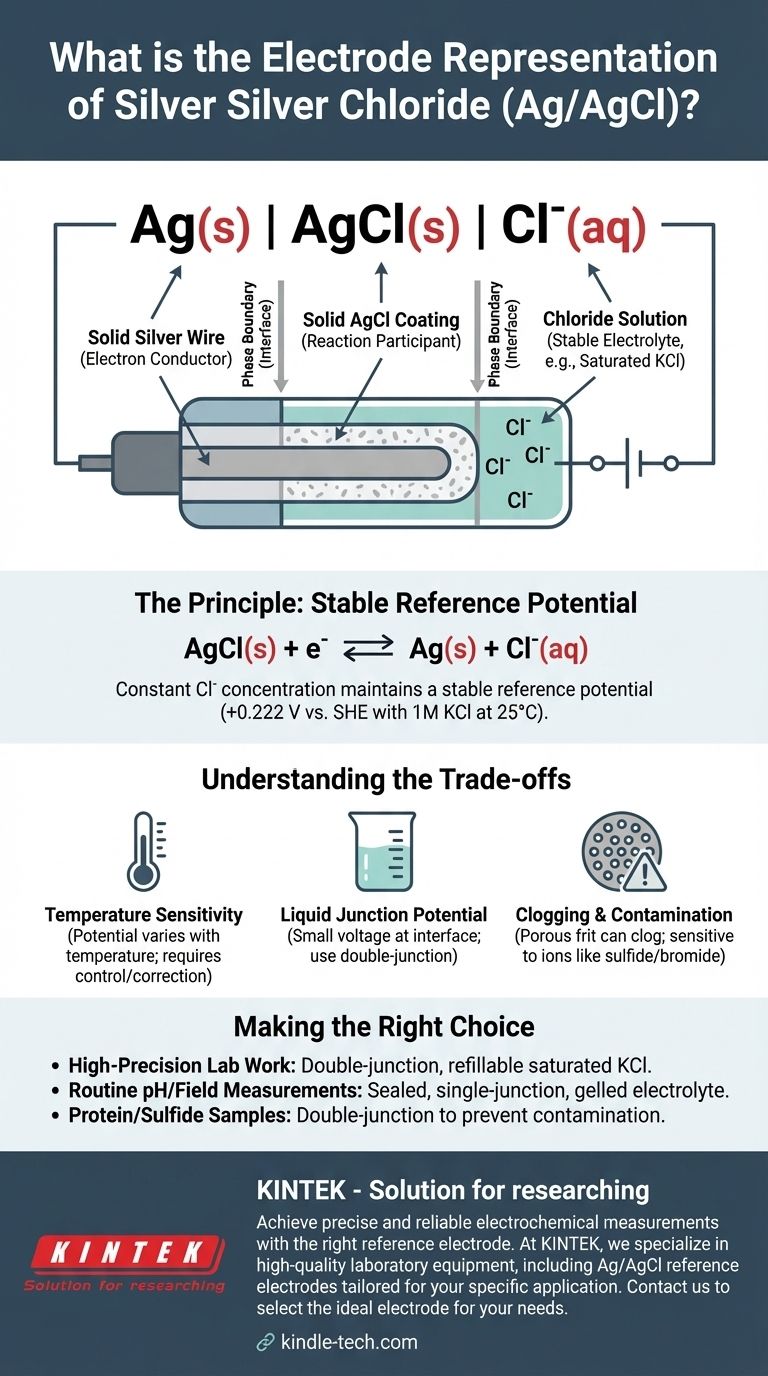
A representação abreviada padrão para um eletrodo de prata-cloreto de prata é Ag(s) | AgCl(s) | Cl⁻(aq). Esta notação eletroquímica descreve as fases física e química do eletrodo, desde o fio de prata metálica sólido até a solução aquosa contendo íons cloreto. O potencial específico do eletrodo depende criticamente da concentração desses íons cloreto.
Esta notação é mais do que um rótulo técnico; é um esquema para um dos eletrodos de referência mais confiáveis e comuns em eletroquímica. Ele descreve um sistema projetado para manter um potencial constante e estável, fornecendo uma linha de base fixa contra a qual os potenciais de outros eletrodos podem ser medidos com precisão.

Desvendando a Notação do Eletrodo
A representação Ag(s) | AgCl(s) | Cl⁻(aq) detalha a estrutura do eletrodo de dentro para fora. Cada componente e símbolo tem um significado preciso.
A Fase Sólida: Ag(s)
Isto representa um fio de prata sólido. Este fio serve como condutor de elétrons, conectando o eletrodo ao circuito de medição externo (um voltímetro ou potenciostato).
A Fronteira de Fase: |
A barra vertical única | significa uma fronteira de fase. Indica a interface onde dois estados físicos diferentes se encontram, neste caso, o metal prata sólido e a camada de cloreto de prata sólido.
A Camada de Sal Insolúvel: AgCl(s)
Isto denota uma camada de cloreto de prata sólido, pouco solúvel, que é revestida diretamente na superfície do fio de prata. Esta camada é o coração da função do eletrodo, participando diretamente da reação eletroquímica.
A Segunda Fronteira de Fase: |
Uma segunda barra vertical marca a fronteira entre o revestimento de cloreto de prata sólido e a solução eletrolítica aquosa circundante.
A Solução Eletrolítica: Cl⁻(aq)
Isto representa a solução aquosa na qual o fio revestido está imerso. Esta solução deve conter uma concentração conhecida e constante de íons cloreto (Cl⁻). Tipicamente, uma solução de cloreto de potássio (KCl) é usada, muitas vezes em uma concentração específica como 1 M ou, mais comumente, uma solução saturada.
O Princípio de um Eletrodo de Referência
O eletrodo Ag/AgCl é valorizado não pela sua própria reação, mas pela sua estabilidade. Ele fornece uma voltagem constante que atua como um ponto zero confiável para outras medições.
A Reação Governante
O potencial estável é estabelecido por um equilíbrio reversível entre os componentes sólidos e os íons cloreto na solução. A meia-reação é:
AgCl(s) + e⁻ ⇌ Ag(s) + Cl⁻(aq)
Desde que a concentração (mais precisamente, a atividade) dos íons cloreto na solução permaneça constante, o potencial desta meia-célula não mudará.
A Importância da Concentração Constante de Cloreto
O uso de uma solução de KCl saturada garante que a concentração de Cl⁻ seja constante e reprodutível. Se alguma água evaporar, mais sal de KCl simplesmente se dissolve para manter a saturação. É por isso que o potencial de referência é tão estável. Para uma solução de KCl 1M a 25°C (298 K), este potencial é de +0,222 V em relação ao Eletrodo Padrão de Hidrogênio (EPH).
Compreendendo as Compensações
Embora altamente confiável, o eletrodo Ag/AgCl não está isento de limitações que exigem consideração para um trabalho preciso.
Sensibilidade à Temperatura
O potencial do eletrodo é uma função da temperatura. Para medições de alta precisão, a temperatura da célula deve ser controlada ou os potenciais medidos devem ser corrigidos para variações de temperatura.
Potencial de Junção Líquida
Quando a solução de KCl do eletrodo entra em contato com uma solução de amostra diferente, uma pequena voltagem conhecida como potencial de junção líquida pode se desenvolver na interface. Isso introduz um pequeno, mas sistemático, erro na medição, que pode ser minimizado usando um eletrodo de dupla junção.
Obstrução e Contaminação
O fritado poroso que permite o contato elétrico entre a solução interna e a amostra pode ficar obstruído. Também pode ser contaminado por íons na amostra (como sulfeto, brometo ou iodeto) que podem reagir com a prata, fazendo com que o potencial do eletrodo varie com o tempo.
Fazendo a Escolha Certa para Sua Medição
Sua aplicação determina qual configuração de eletrodo é a melhor.
- Se o seu foco principal for trabalho laboratorial de alta precisão: Use um eletrodo Ag/AgCl de dupla junção com uma solução de KCl saturada reabastecível para minimizar o potencial de junção e permitir fácil manutenção.
- Se o seu foco principal for pH de rotina ou medições de campo: Um eletrodo de junção simples selado com um eletrólito em gel é durável, de baixa manutenção e perfeitamente adequado.
- Se o seu foco principal for a análise de amostras contendo proteínas ou sulfetos: Você deve usar um eletrodo de dupla junção para evitar o entupimento e a contaminação da junção de referência primária.
Compreender esta notação a transforma de um rótulo críptico em um esquema funcional para medição eletroquímica confiável.
Tabela de Resumo:
| Componente | Símbolo | Descrição |
|---|---|---|
| Fio de Prata Sólida | Ag(s) | Condutor conectado ao circuito externo. |
| Revestimento de Cloreto de Prata | AgCl(s) | Camada de sal insolúvel que permite a reação reversível. |
| Solução de Íons Cloreto | Cl⁻(aq) | Eletrólito aquoso (por exemplo, KCl) com concentração constante de Cl⁻. |
| Fronteira de Fase |
Obtenha medições eletroquímicas precisas e confiáveis com o eletrodo de referência correto.
Na KINTEK, especializamo-nos em equipamentos laboratoriais de alta qualidade, incluindo uma gama de eletrodos de referência Ag/AgCl adaptados para sua aplicação específica — quer você precise de modelos de dupla junção de alta precisão para trabalhos laboratoriais sensíveis ou opções duráveis e de baixa manutenção para análise de rotina.
Nossos especialistas podem ajudá-lo a selecionar o eletrodo ideal para garantir um potencial estável, minimizar erros e aumentar a precisão de sua pesquisa.
Entre em contato com a KINTEK hoje para discutir suas necessidades laboratoriais e descobrir como nossos consumíveis e equipamentos confiáveis podem apoiar seu trabalho.
Guia Visual
Produtos relacionados
- Eletrodo de Referência Calomelano Cloreto de Prata Sulfato de Mercúrio para Uso Laboratorial
- Eletrodo Eletroquímico de Disco Metálico
- Eletrodo de Disco de Platina Rotativo para Aplicações Eletroquímicas
- Eletrodo de Disco de Ouro
- Eletrodo de disco rotativo (disco de anel) RRDE / compatível com PINE, ALS japonês, Metrohm suíço de carbono vítreo platina
As pessoas também perguntam
- Por que um fio de platina é comumente usado como eletrodo auxiliar na pesquisa de corrosão de cerâmicas de alumina? Pureza dos Dados
- Quais parâmetros exigem monitoramento durante um experimento envolvendo uma escova de fibra de carbono? Garanta Resultados Confiáveis
- Como a seleção do material do eletrodo impacta o tratamento de águas residuais? Otimize a Eficiência de Remoção de Bioenergia e DQO
- Quais precauções de segurança elétrica devem ser tomadas ao usar o suporte de eletrodo? Uma Estratégia de Segurança de Camada Dupla
- Por que uma haste de grafite porosa é selecionada como eletrodo auxiliar para testar eletrodos de papel de carbono modificados?
- Quais são as funções principais de uma estação de trabalho eletroquímica de alta precisão? Otimizar a Análise de Filme Passivo 304L
- Como um Eletrodo de Disco Rotativo (RDE) de laboratório facilita a avaliação da reestruturação de nanocubos de cobre?
- Que verificações regulares devem ser realizadas em um suporte de eletrodo? Um guia de 3 etapas para medições confiáveis



















