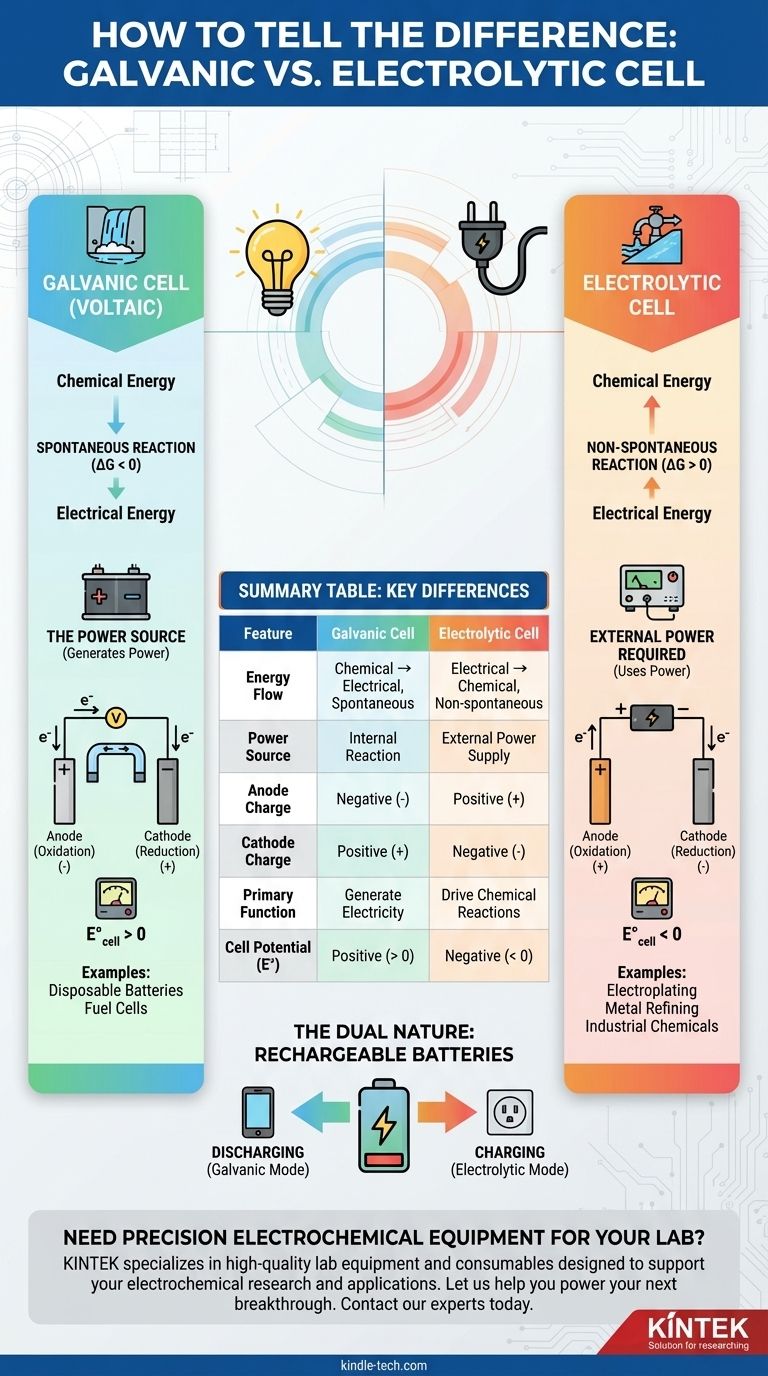
A diferença fundamental entre uma célula galvânica e uma célula eletrolítica reside no fluxo de energia. Uma célula galvânica, também conhecida como célula voltaica, utiliza uma reação química espontânea para gerar energia elétrica. Em contraste, uma célula eletrolítica utiliza energia elétrica externa para forçar a ocorrência de uma reação química não espontânea.
Pense assim: Uma célula galvânica é como uma cachoeira gerando energia à medida que flui naturalmente para baixo. Uma célula eletrolítica é como uma bomba usando energia externa para empurrar a água de volta para cima, contra a gravidade.

O Princípio Central: Espontaneidade e Conversão de Energia
O comportamento de qualquer célula eletroquímica é ditado se sua reação interna ocorre por si mesma ou requer intervenção externa.
Células Galvânicas: Liberando Energia Química
Uma célula galvânica é definida por uma reação redox espontânea. Isso significa que a reação quer acontecer por si mesma, liberando energia no processo.
Este processo converte energia química armazenada diretamente em energia elétrica. A própria célula é a fonte de energia.
Termodinamicamente, isso corresponde a uma energia livre de Gibbs negativa (ΔG < 0) e um potencial de célula positivo (E°_célula > 0).
Células Eletrolíticas: Inserindo Energia Elétrica
Uma célula eletrolítica envolve uma reação não espontânea. Sem um impulso externo, esta reação não ocorreria.
Ela requer uma fonte de energia externa, como uma bateria ou fonte de corrente contínua (DC), para impulsionar a reação. Este processo converte energia elétrica em energia química.
Isso corresponde a uma energia livre de Gibbs positiva (ΔG > 0) e um potencial de célula negativo (E°_célula < 0). A voltagem externa deve ser maior que este potencial negativo para forçar a reação.
Como Identificar Cada Célula: Indicadores Chave
Além da direção do fluxo de energia, você pode distinguir entre as duas células observando a polaridade do eletrodo e o circuito geral.
A Fonte de Energia
Este é o indicador mais direto. Se a célula eletroquímica é a bateria que alimenta um dispositivo, é uma célula galvânica.
Se a célula está conectada a uma bateria externa ou fonte de energia, é uma célula eletrolítica. A fonte externa fornece a energia para impulsionar o processo.
Polaridade do Eletrodo (Um Ponto Comum de Confusão)
As definições de ânodo e cátodo são constantes para ambos os tipos de células:
- Ânodo: O eletrodo onde ocorre a oxidação.
- Cátodo: O eletrodo onde ocorre a redução.
No entanto, sua carga positiva/negativa (polaridade) se inverte:
Em uma célula galvânica, a reação espontânea no ânodo libera elétrons, tornando-o o terminal negativo (-). O cátodo, que consome elétrons, é o terminal positivo (+).
Em uma célula eletrolítica, a fonte de energia externa dita a polaridade. Ela puxa elétrons do ânodo, tornando-o o terminal positivo (+), e empurra elétrons para o cátodo, tornando-o o terminal negativo (-).
Aplicações Comuns e Armadilhas
O propósito da célula é seu diferenciador mais prático. Uma cria energia, enquanto a outra usa energia para criar uma substância ou mudança.
O Propósito de uma Célula Galvânica
A única função de uma célula galvânica é atuar como fonte de energia elétrica.
Exemplos comuns incluem baterias descartáveis (AA, AAA), células a combustível e a função primária de uma bateria de carro ao ligar o motor.
O Propósito de uma Célula Eletrolítica
O objetivo de uma célula eletrolítica é impulsionar uma transformação química útil que não ocorreria de outra forma.
Aplicações típicas incluem a eletrodeposição de uma fina camada de metal em uma superfície, o refino de metais como cobre e alumínio e a produção de produtos químicos industriais como gás cloro.
A Natureza Dupla das Baterias Recarregáveis
Uma bateria recarregável é o exemplo perfeito de ambos os tipos de células em um único dispositivo.
- Ao descarregar (alimentando seu telefone): Ela atua como uma célula galvânica, com uma reação espontânea gerando eletricidade.
- Ao carregar (conectada à tomada): Ela atua como uma célula eletrolítica, com energia externa forçando a reação inversa não espontânea para armazenar energia.
Fazendo a Distinção Correta para Seu Objetivo
Para determinar rapidamente com qual célula você está lidando, concentre-se no fluxo de energia e no objetivo geral do sistema.
- Se seu foco principal é gerar energia: Você está lidando com uma célula galvânica, onde uma reação espontânea libera energia.
- Se seu foco principal é criar uma substância ou reverter uma reação: Você está usando uma célula eletrolítica, que requer uma fonte de energia externa para impulsionar um processo não espontâneo.
- Se você está analisando os sinais dos eletrodos: Lembre-se de que em uma célula galvânica o ânodo é negativo, enquanto em uma célula eletrolítica ele é positivo, porque a fonte de energia é interna ou externa.
Em última análise, entender se a energia é um produto ou uma exigência é a chave para distinguir entre essas duas células eletroquímicas fundamentais.
Tabela Resumo:
| Característica | Célula Galvânica | Célula Eletrolítica |
|---|---|---|
| Fluxo de Energia | Química → Elétrica (Espontânea) | Elétrica → Química (Não espontânea) |
| Fonte de Energia | Reação Interna | Fonte de Alimentação Externa |
| Carga do Ânodo | Negativa (-) | Positiva (+) |
| Carga do Cátodo | Positiva (+) | Negativa (-) |
| Função Primária | Gerar Eletricidade | Impulsionar Reações Químicas (ex: eletrodeposição) |
| Potencial da Célula (E°) | Positivo (> 0) | Negativo (< 0) |
Precisa de Equipamento Eletroquímico de Precisão para Seu Laboratório?
Compreender as nuances das células galvânicas e eletrolíticas é crucial para o trabalho laboratorial avançado. Seja você desenvolvendo novas tecnologias de bateria, realizando eletrodeposição ou conduzindo análises de materiais, ter o equipamento certo é essencial.
A KINTEK é especializada em equipamentos e consumíveis de laboratório de alta qualidade projetados para apoiar sua pesquisa e aplicações eletroquímicas. Fornecemos soluções confiáveis que garantem resultados precisos e aumentam a eficiência do seu laboratório.
Deixe-nos ajudá-lo a impulsionar sua próxima descoberta. Entre em contato com nossos especialistas hoje para discutir suas necessidades específicas de laboratório e descobrir como nossos produtos podem impulsionar seu sucesso.
Guia Visual
Produtos relacionados
- Célula Eletroquímica Eletrolítica com Cinco Portas
- Célula Eletrolítica Eletroquímica para Avaliação de Revestimentos
- Célula de Gás de Eletrólise Eletroquímica Eletrolítica Célula de Reação de Fluxo Líquido
- Equipamento de Laboratório de Baterias Testador Abrangente de Capacidade de Bateria
- Papel de Carbono Hidrofílico TGPH060 para Aplicações de Laboratório de Baterias
As pessoas também perguntam
- Qual é a função de uma célula eletroquímica de três eletrodos? Aprimore a precisão na pesquisa de passivação de ligas
- Como o design de uma célula eletrolítica eletroquímica influencia a uniformidade do revestimento? Otimize Seus Catalisadores
- Qual papel uma célula de corrosão eletrolítica desempenha na análise de aço Cr-Ni-Ti forjado? Revelando microestruturas ocultas
- Qual é a necessidade de resfriamento na PEO? Domine o Gerenciamento Térmico para Oxidação Eletrolítica de Plasma de Alta Qualidade
- Como é construído o corpo da célula de eletrólise? Um guia sobre materiais e componentes
- Quais são os procedimentos completos pós-experimento para uma célula eletrolítica de corrosão de placa plana? Um Guia Passo a Passo para Resultados Confiáveis
- Qual função uma célula eletroquímica de três eletrodos desempenha? Gravação de Precisão para Grafeno de Alta Qualidade
- Qual é a função principal de uma célula eletrolítica na preparação da liga Fe-W? Domine a Eletrodeposição de Precisão




