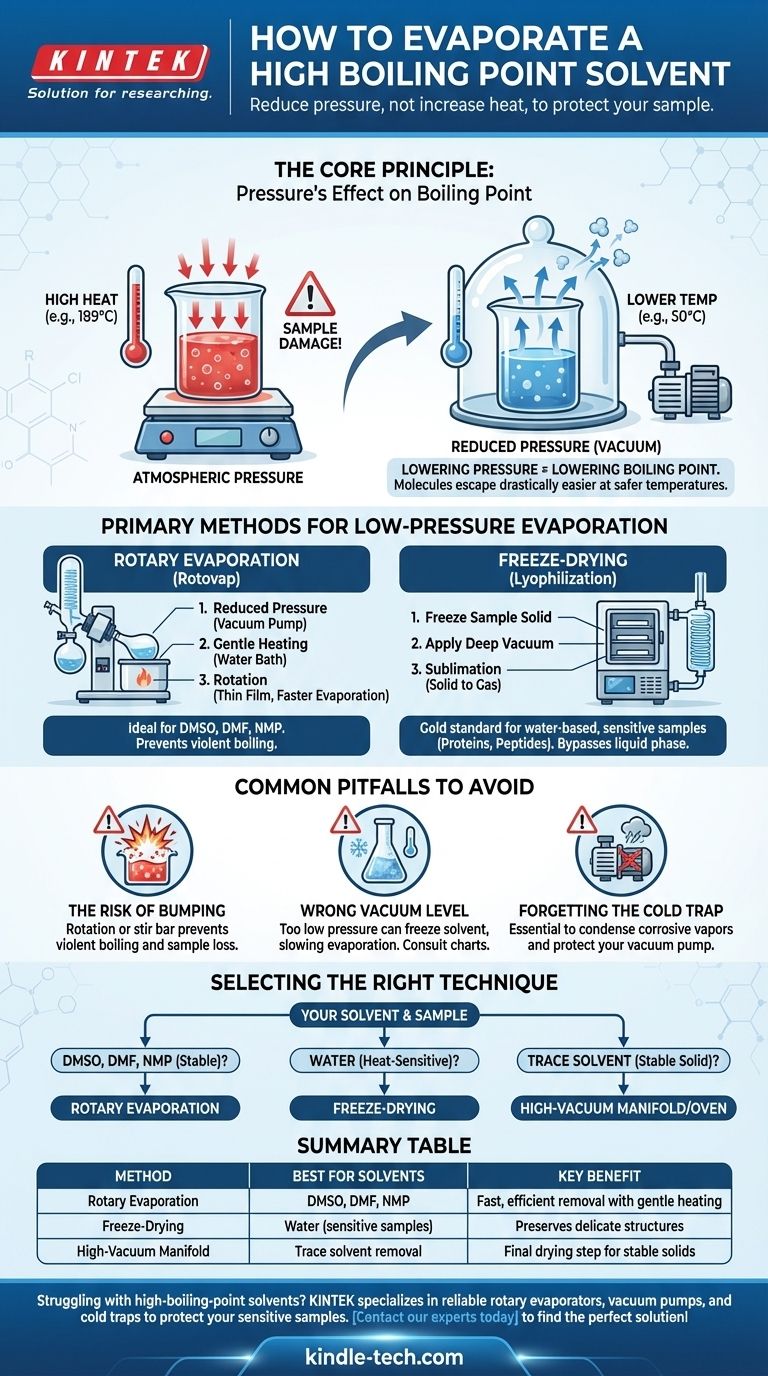
Evaporar um solvente de alto ponto de ebulição é um desafio laboratorial comum, onde simplesmente adicionar mais calor é frequentemente contraproducente e pode destruir sua amostra. A solução não é forçar a evaporação com altas temperaturas, mas sim mudar o ambiente, reduzindo significativamente a pressão. Isso diminui o ponto de ebulição do solvente, permitindo que ele vaporize de forma suave e eficiente a uma temperatura muito mais segura e baixa.
O princípio central é este: em vez de lutar contra o alto ponto de ebulição do solvente com calor destrutivo, você muda as regras do jogo. Ao aplicar vácuo, você torna drasticamente mais fácil para as moléculas do solvente escaparem, permitindo uma evaporação rápida à temperatura ambiente ou próxima dela.

O Princípio Central: O Efeito da Pressão no Ponto de Ebulição
Para remover eficazmente um solvente de alto ponto de ebulição, você primeiro precisa entender a física em jogo. O processo é inteiramente regido pela relação entre temperatura, pressão e o estado físico do solvente.
O Que Define um Ponto de Ebulição?
Um líquido ferve na temperatura em que sua pressão de vapor — a pressão exercida por sua forma gasosa — se iguala à pressão do ambiente ao seu redor.
Ao nível do mar, a água ferve a 100°C porque essa é a temperatura na qual sua pressão de vapor é igual à pressão atmosférica padrão (~760 torr).
A Relação Pressão-Temperatura
A percepção chave é que, se você puder diminuir a pressão ambiental, você também diminui a temperatura necessária para o solvente ferver.
Pense nisso como remover uma tampa pesada de um recipiente. Com menos pressão pressionando a superfície do líquido, suas moléculas podem escapar para a fase gasosa com muito mais facilidade e com menos energia (calor).
Por Que Isso Protege Sua Amostra
Muitos compostos químicos, especialmente moléculas orgânicas complexas ou materiais biológicos, são termicamente sensíveis.
Aplicar o alto calor necessário para ferver algo como DMSO (ponto de ebulição: 189°C) à pressão atmosférica quase certamente causaria decomposição, reações secundárias ou polimerização, destruindo seu produto final. A evaporação a baixa pressão evita isso completamente.
Métodos Principais para Evaporação a Baixa Pressão
Os laboratórios usam equipamentos especializados projetados para explorar a relação pressão-temperatura. Os dois métodos mais comuns são a evaporação rotativa e a liofilização.
O Evaporador Rotativo ("Rotovap")
Um evaporador rotativo é o cavalo de batalha mais comum para esta tarefa. Ele remove solventes de forma eficiente ao combinar três ações simultaneamente.
- Pressão Reduzida: Uma bomba de vácuo diminui a pressão dentro do sistema.
- Aquecimento Suave: Um banho-maria fornece um nível controlado e baixo de calor ao balão.
- Rotação: Girar o balão espalha a amostra em um filme fino, aumentando drasticamente a área de superfície para uma evaporação mais rápida e prevenindo a ebulição violenta (respingos).
Este método é ideal para remover solventes orgânicos comuns de alto ponto de ebulição, como DMSO, DMF e NMP.
Liofilização (Freeze-Drying)
Para as amostras mais sensíveis, especialmente aquelas em água, a liofilização é o padrão ouro. Este processo ignora completamente a fase líquida.
Primeiro, a amostra é congelada até ficar sólida. Em seguida, aplica-se um vácuo muito profundo. Sob essas condições, o solvente congelado sublima — passando diretamente de sólido para gás — que é então capturado por um condensador extremamente frio.
Esta técnica é essencial para preservar a estrutura de materiais delicados como proteínas, peptídeos e nanopartículas que seriam danificados por qualquer quantidade de calor ou pelo estresse físico da evaporação convencional.
Armadilhas Comuns a Evitar
Embora poderosas, essas técnicas exigem execução adequada para serem eficazes e seguras. Entender os problemas potenciais é crucial para o sucesso.
O Risco de "Bumping" (Ebulição Explosiva)
Sob vácuo, um líquido pode, às vezes, superaquecer e ferver explosivamente em um fenômeno chamado bumping. Isso pode fazer com que você perca uma parte significativa de sua amostra para o condensador.
A rotação de um rotovap é a principal defesa contra o bumping. Para sistemas de vácuo estáticos, adicionar uma barra magnética pode ajudar.
Escolhendo o Nível de Vácuo Correto
Mais vácuo nem sempre é melhor. Se a pressão for muito baixa, você pode acidentalmente congelar seu solvente no balão (um problema comum com água em um rotovap), o que retarda drasticamente a evaporação.
Sempre consulte um gráfico de pressão de vapor ou um nomograma para o seu solvente específico para encontrar as configurações ideais de temperatura e pressão.
O Armadilha Fria é Inegociável
Uma armadilha fria — um condensador resfriado com gelo seco/acetona ou nitrogênio líquido — deve ser sempre colocada entre seu aparelho e a bomba de vácuo.
Os vapores de solvente são altamente corrosivos e destruirão o óleo e os componentes internos de uma bomba desprotegida. A armadilha fria condensa esses vapores em um líquido ou sólido, poupando-o de um reparo muito caro.
Selecionando a Técnica Certa para Seu Solvente
Sua escolha de método depende inteiramente do solvente que você está removendo e da sensibilidade do seu composto.
- Se o seu solvente for DMSO, DMF ou NMP: Um evaporador rotativo conectado a uma bomba de vácuo adequada e protegido por uma armadilha fria é o método padrão da indústria.
- Se o seu solvente for água e sua amostra for altamente sensível ao calor (por exemplo, uma proteína): A liofilização é a escolha superior para preservar sua estrutura delicada.
- Se você estiver removendo quantidades finais e vestigiais de solvente de um sólido estável: Um manifold de alto vácuo (linha Schlenk) ou um forno a vácuo podem ser usados para a etapa final de secagem após a remoção em massa.
Dominar o controle de pressão é a chave para isolar eficientemente seu composto puro sem comprometer.
Tabela de Resumo:
| Método | Melhor Para Solventes | Benefício Principal |
|---|---|---|
| Evaporação Rotativa | DMSO, DMF, NMP | Remoção rápida e eficiente com aquecimento suave |
| Liofilização | Água (para amostras sensíveis) | Preserva estruturas delicadas como proteínas |
| Manifold de Alto Vácuo | Remoção de solvente residual | Etapa final de secagem para sólidos estáveis |
Com dificuldades com solventes de alto ponto de ebulição? A KINTEK é especializada em equipamentos e consumíveis de laboratório, fornecendo evaporadores rotativos, bombas de vácuo e armadilhas frias confiáveis para garantir que suas amostras sensíveis sejam protegidas durante a evaporação. Nossa experiência ajuda laboratórios como o seu a obter compostos puros e intactos de forma eficiente. Entre em contato com nossos especialistas hoje mesmo para encontrar a solução de evaporação perfeita para suas necessidades!
Guia Visual
Produtos relacionados
- Bomba de Vácuo de Água Circulante para Uso Laboratorial e Industrial
- Bomba de Vácuo Rotativa de Palhetas de Laboratório para Uso em Laboratório
- Bomba de Vácuo de Diafragma Sem Óleo para Uso Laboratorial e Industrial
- Prensa Térmica Hidráulica Elétrica a Vácuo para Laboratório
- Máquina de Montagem a Frio a Vácuo para Preparação de Amostras
As pessoas também perguntam
- O grafite encolhe? O Papel Crítico da Temperatura e da Radiação na Estabilidade Dimensional
- Como funciona um forno industrial? Componentes principais e aplicações explicados
- Por que o ultrassom de alta potência é utilizado para MOFs em MMMs? Desbloqueie Separação de Gás Superior e Dispersão Uniforme
- O que é o processo de soldagem por prensagem isostática a quente? Obtenha uma união de materiais sem costura e de alta resistência
- O que é a pulverização catódica em termos simples? Um Guia para Deposição de Filmes Finos de Alta Qualidade
- Qual é o método de sinterização por plasma de faísca? Uma Técnica de Consolidação de Pó de Alta Velocidade
- Qual é a sequência do processo de tratamento térmico? Domine as 3 Etapas para Propriedades de Material Perfeitas
- Quais são as principais considerações técnicas para o uso de tampões de lã de quartzo? Otimize sua célula de reação espectroscópica



















