Requisitos para a utilização de eléctrodos de referência
Elétrodo não polarizado ideal
Um elétrodo não polarizado ideal serve como pedra angular nas medições electroquímicas, fornecendo um ponto de referência estável e fiável. Este tipo de elétrodo é caracterizado pela sua excelente reversibilidade, que assegura que o potencial do elétrodo permanece consistente independentemente da direção do fluxo de corrente. Um potencial estável é crucial, pois minimiza as flutuações e os erros nas medições, aumentando assim a precisão e a fiabilidade dos dados obtidos.
Além disso, a reprodutibilidade do potencial de um elétrodo não polarizado ideal é fundamental. Isto significa que o elétrodo deve produzir consistentemente o mesmo potencial em condições idênticas, eliminando discrepâncias em experiências repetidas. Esta reprodutibilidade é essencial para o rigor científico e para garantir que os resultados experimentais podem ser comparados e reproduzidos de forma fiável.
Para ilustrar estas qualidades, considere a seguinte tabela que compara as caraterísticas dos eléctrodos de referência ideais e não ideais:
| Caraterística | Elétrodo de referência ideal | Elétrodo de referência não ideal |
|---|---|---|
| Reversibilidade do elétrodo | Alta | Baixa |
| Estabilidade do potencial | Alta | Variável |
| Potencial Reprodutibilidade | Alta | Baixa |
Em resumo, um elétrodo não polarizado ideal deve apresentar uma elevada reversibilidade do elétrodo, um potencial estável e uma excelente reprodutibilidade do potencial para funcionar eficazmente como referência em estudos electroquímicos.
Coeficiente de temperatura e manutenção
O coeficiente de temperatura de um elétrodo de referência é um parâmetro crítico que influencia o seu desempenho e fiabilidade. Idealmente, o elétrodo deve apresentar um coeficiente de temperatura mínimo, garantindo que o seu potencial se mantém estável em condições ambientais variáveis. Esta estabilidade é crucial para medições precisas em experiências electroquímicas, onde mesmo pequenas flutuações no potencial podem levar a erros significativos.
Para além de um pequeno coeficiente de temperatura, o elétrodo deve ser de fácil utilização em termos de fabrico, funcionamento e manutenção. A facilidade de fabrico assegura uma qualidade e disponibilidade consistentes, enquanto a utilização direta simplifica a configuração experimental e reduz a probabilidade de erros operacionais. Os requisitos de manutenção devem ser mínimos, permitindo uma utilização a longo prazo sem calibração ou substituição frequentes.
| Aspeto | Caraterísticas ideais | Importância |
|---|---|---|
| Coeficiente de temperatura | Pequeno | Assegura um potencial estável a várias temperaturas |
| Fabrico | Fácil de produzir | Assegura uma qualidade e disponibilidade consistentes |
| Utilização | Simples e intuitivo | Simplifica a configuração experimental e reduz os erros |
| Manutenção | Mínima | Permite uma utilização a longo prazo sem intervenções frequentes |
Ao concentrarem-se nestes aspectos, os investigadores podem selecionar e manter eléctrodos de referência que fornecem dados fiáveis e precisos, contribuindo para o sucesso dos seus estudos electroquímicos.
Condições de utilização de diferentes eléctrodos de referência
Classificação com base no pH
Ao selecionar um elétrodo de referência para experiências electroquímicas, o pH do eletrólito é um fator crítico. Os diferentes eléctrodos de referência são especificamente concebidos para funcionar de forma óptima em condições de pH variáveis, garantindo medições precisas e estáveis.
Condições ácidas
Para ambientes com pH baixo, eléctrodos de calomelano são normalmente utilizados. Estes eléctrodos são fiáveis em ambientes ácidos devido à sua estabilidade e ao facto de não reagirem com soluções ácidas. O elétrodo de calomelano é constituído por mercúrio em contacto com uma pasta de cloreto de mercúrio (I) (calomelano) e uma solução de cloreto de potássio, que proporciona um potencial estável.

Condições neutras
Em ambientes de pH neutro, eléctrodos de cloreto de prata são a escolha preferida. Este tipo de elétrodo é composto por um fio de prata revestido de cloreto de prata, que é imerso numa solução de cloreto de potássio ou de cloreto de sódio. O elétrodo de cloreto de prata oferece uma excelente estabilidade e um baixo coeficiente de temperatura, tornando-o adequado para uma vasta gama de aplicações.
Condições alcalinas
Para ambientes com pH elevado, eléctrodos de óxido de mercúrio-mercúrio são utilizados. Estes eléctrodos são feitos de mercúrio em contacto com uma pasta de óxido de mercúrio e solução de hidróxido de potássio. O elétrodo de óxido de mercúrio-mercúrio é estável em condições alcalinas e fornece um potencial consistente, o que é crucial para medições precisas em tais ambientes.
| Tipo de elétrodo | Intervalo de pH ótimo | Componentes |
|---|---|---|
| Elétrodo de calomelano | Ácido (pH baixo) | Mercúrio, pasta de cloreto de mercúrio (I), solução de cloreto de potássio |
| Elétrodo de cloreto de prata | Neutro (pH médio) | Fio de prata revestido com cloreto de prata, cloreto de potássio ou solução de cloreto de sódio |
| Elétrodo de mercúrio-óxido de mercúrio | Alcalino (pH elevado) | Mercúrio, pasta de óxido de mercúrio, solução de hidróxido de potássio |
A compreensão dos requisitos específicos de pH para cada tipo de elétrodo de referência garante a escolha do elétrodo mais adequado, aumentando assim a precisão e a fiabilidade das medições electroquímicas.
Casos especiais e electrólitos orgânicos
Em cenários específicos, como os que envolvem ácido sulfúrico ou soluções de sulfato, os eléctrodos de mercúrio e sulfato de mercúrio são utilizados devido à sua compatibilidade com estes ambientes agressivos. Estes eléctrodos são particularmente eficazes na manutenção de potenciais estáveis e na garantia de medições precisas em condições tão agressivas.
No domínio da tecnologia de baterias, os eléctrodos de hidróxido de cádmio são predominantes. Estes eléctrodos são escolhidos pela sua capacidade de suportar as exigências cíclicas do funcionamento das baterias, proporcionando um desempenho fiável durante períodos prolongados.
Para aplicações que envolvem electrólitos orgânicos, os eléctrodos de prata e de ferroceno são frequentemente as escolhas preferidas. Os eléctrodos de prata são valorizados pela sua estabilidade e baixa reatividade com compostos orgânicos, enquanto os eléctrodos de ferroceno oferecem vantagens únicas em termos das suas propriedades redox e compatibilidade com meios orgânicos.
| Tipo de eletrólito | Elétrodo preferido | Principais vantagens |
|---|---|---|
| Soluções de ácido sulfúrico | Sulfato de Mercúrio Mercúrio | Compatibilidade com ambientes agressivos, potencial estável |
| Indústria de baterias | Hidróxido de cádmio | Resistência em operações cíclicas de baterias, desempenho fiável |
| Electrólitos orgânicos | Prata e Ferroceno | Estabilidade com compostos orgânicos, propriedades redox únicas |
Esta tabela resume os eléctrodos preferidos para diferentes tipos de electrólitos, destacando as suas principais vantagens em várias aplicações.
Porque é que diferentes eléctrodos de referência se aplicam a diferentes condições
Reação do elétrodo e Equação de Nernst
Os diferentes eléctrodos são adaptados a condições específicas com base nas suas reacções de elétrodo únicas e nos potenciais de elétrodo de equilíbrio padrão resultantes, que são meticulosamente calculados utilizando a equação de Nernst. Esta equação, que recebeu o nome do químico alemão Walther Nernst, é fundamental em eletroquímica, uma vez que relaciona o potencial de redução de uma reação eletroquímica com o potencial de elétrodo padrão e as actividades das espécies que reagem.
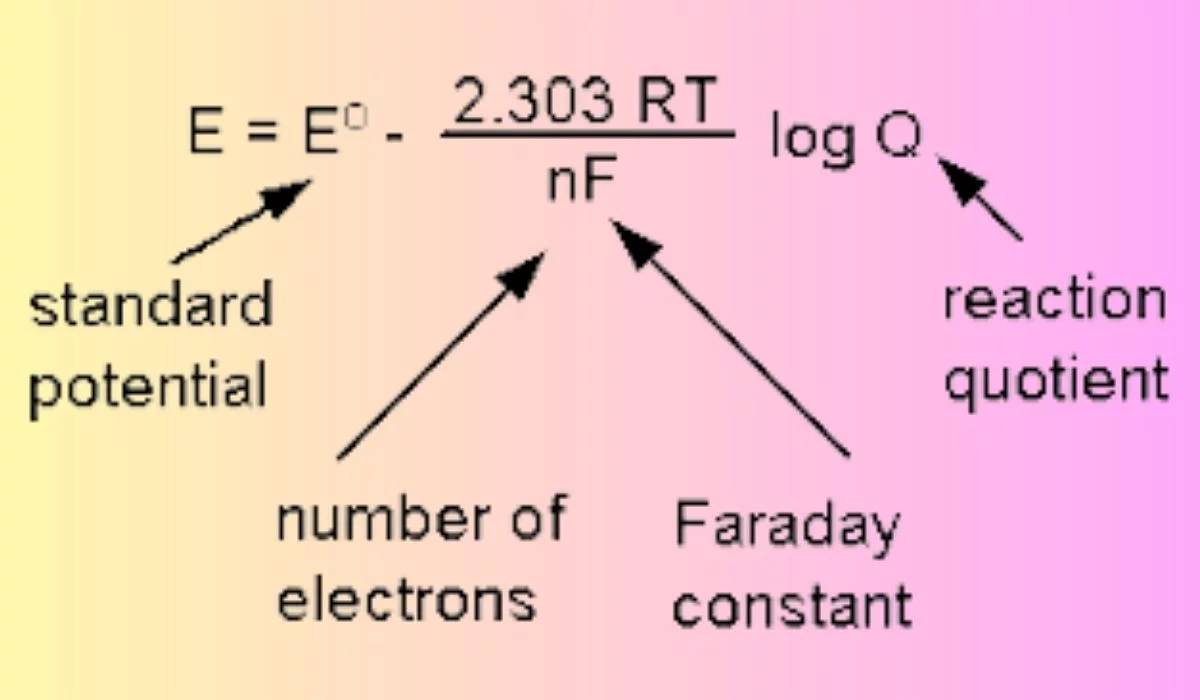
Por exemplo, o potencial de elétrodo de equilíbrio padrão de um elétrodo de cloreto de prata, frequentemente utilizado em ambientes neutros, é influenciado pela concentração de iões cloreto e pela pressão parcial do gás hidrogénio. Em contraste, um elétrodo de calomelano, preferido em condições ácidas, funciona segundo princípios termodinâmicos diferentes, garantindo estabilidade e precisão no ambiente designado.
| Tipo de elétrodo | Condições adequadas | Reação chave | Potencial de equilíbrio padrão (V) |
|---|---|---|---|
| Cloreto de prata | Neutro | AgCl + e- → Ag + Cl- | 0.2223 |
| Calomelano | Ácido | Hg₂Cl₂ + 2e- → 2Hg + 2Cl- | 0.2682 |
| Óxido de Mercúrio-Mercúrio | Alcalino | HgO + H₂O + 2e- → Hg + 2OH- | 0.0977 |
A seleção de um elétrodo adequado é crucial, uma vez que tem um impacto direto na precisão e fiabilidade das medições electroquímicas. A adequação de cada elétrodo é determinada pela sua capacidade de manter um potencial estável em condições variáveis, assegurando que a equação de Nernst prevê com precisão o comportamento do elétrodo. Esta precisão é essencial para aplicações que vão desde a monitorização ambiental à tecnologia de baterias, onde mesmo pequenos desvios podem levar a erros significativos.
Em resumo, a equação de Nernst não só quantifica a relação entre o potencial do elétrodo e as condições de reação, como também sublinha a importância de escolher o elétrodo certo para aplicações específicas. Isto assegura que as experiências electroquímicas produzam resultados precisos e reprodutíveis, alinhados com os objectivos mais amplos da investigação científica e da prática industrial.
Estabilidade e Desvantagens
O elétrodo de cloreto de prata é um excelente exemplo de como as condições específicas podem afetar a estabilidade e a precisão dos eléctrodos de referência. Em condições alcalinas, a utilização prolongada deste elétrodo pode resultar na formação de óxido de prata. Esta reação não só compromete a estabilidade do elétrodo, como também diminui a sua precisão, afectando assim a fiabilidade das medições efectuadas.
Em ambientes alcalinos, a reação química pode ser resumida da seguinte forma:
- Cloreto de Prata (AgCl) + Hidróxido (OH-) → Óxido de Prata (Ag₂O) + Cloreto (Cl-)
Esta transformação altera significativamente o potencial do elétrodo, tornando-o menos previsível e mais sujeito a erros. A instabilidade introduzida pela formação de óxido de prata requer uma consideração cuidadosa ao selecionar e utilizar eléctrodos de referência em tais condições.
Para atenuar estas desvantagens, recomenda-se frequentemente a utilização de um sistema de ponte salina dupla. Este método ajuda a manter a estabilidade do elétrodo de cloreto de prata em condições alcalinas, assegurando leituras mais precisas e fiáveis.
Atenuação das desvantagens com pontes salinas
Em condições alcalinas, os eléctrodos de cloreto de prata podem enfrentar problemas de estabilidade devido à formação de óxido de prata ao longo do tempo, o que afecta a precisão e a fiabilidade das medições. Para contrariar estas desvantagens, a utilização de um sistema de ponte salina dupla é uma estratégia eficaz.
Um sistema de ponte salina dupla envolve a utilização de duas pontes salinas separadas, cada uma preenchida com um eletrólito adequado. Esta configuração ajuda a isolar o elétrodo de referência da solução de teste, reduzindo assim o risco de contaminação e minimizando a interação que poderia levar à formação de óxido de prata. Ao criar uma zona tampão, o sistema de ponte salina dupla garante que o elétrodo de referência permanece estável, mesmo em ambientes alcalinos difíceis.
Este método não só preserva a integridade do elétrodo de cloreto de prata, como também aumenta a precisão geral das medições electroquímicas. O duplo isolamento proporcionado pelas pontes salinas actua como uma barreira protetora, permitindo uma recolha de dados mais consistente e fiável em condições alcalinas.
Produtos relacionados
- Eletrodo de Referência Calomelano Cloreto de Prata Sulfato de Mercúrio para Uso Laboratorial
- Eletrodo de Referência de Sulfato de Cobre para Uso em Laboratório
- Célula Eletrolítica Eletroquímica de Corrosão Plana
- Suporte de Eletrodo para Experimentos Eletroquímicos
- Eletrodo Auxiliar de Platina para Uso Laboratorial
Artigos relacionados
- Eléctrodos electroquímicos na análise química
- Eléctrodos de referência: Calomel, Cloreto de Prata e Sulfato de Mercúrio - Um Guia Completo
- Guia para principiantes para compreender os eléctrodos de referência em eletroquímica
- Electrólitos e eléctrodos electroquímicos
- Um guia completo para eléctrodos de referência















