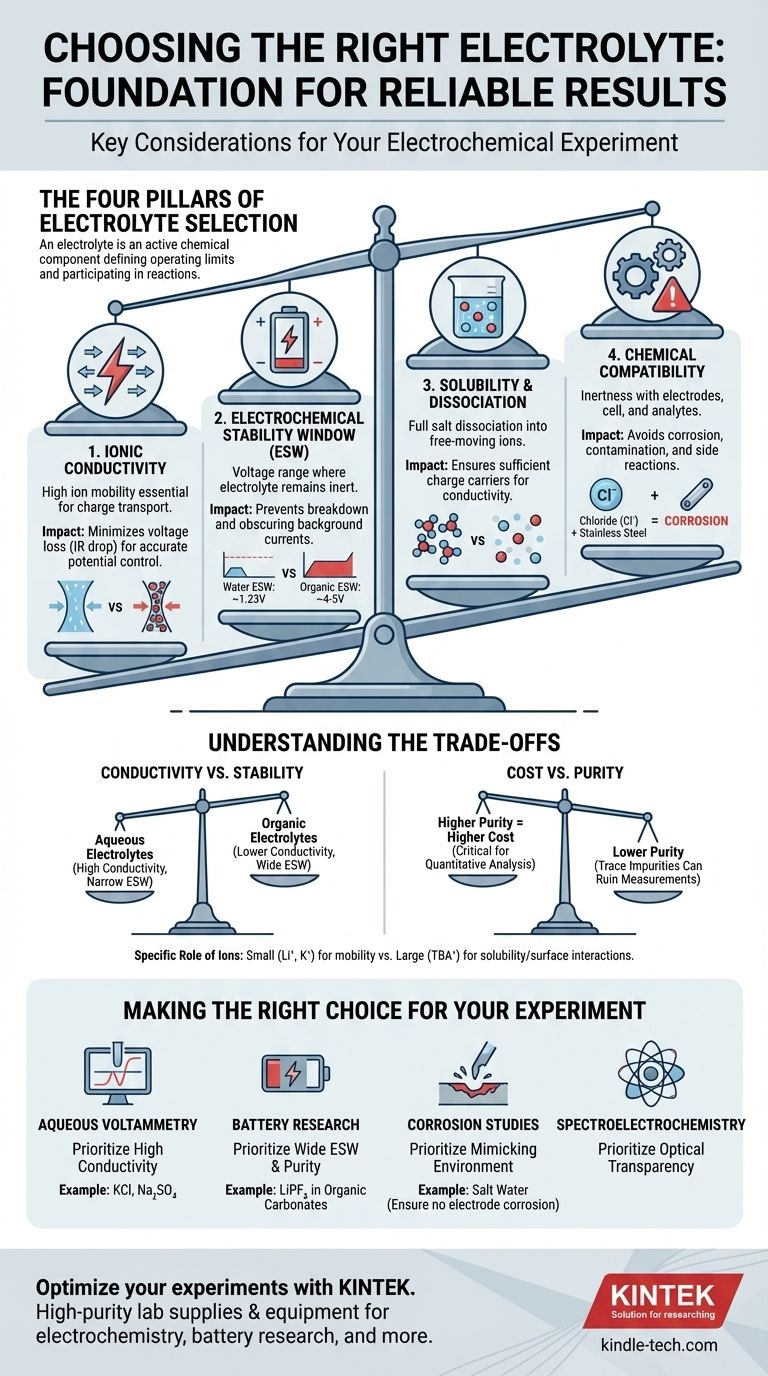
Ao selecionar um eletrólito para um experimento, você deve avaliar quatro propriedades chave: sua condutividade iônica, sua janela de estabilidade eletroquímica, sua solubilidade no solvente escolhido e sua compatibilidade química com todo o seu sistema experimental. Esses fatores, em conjunto, determinam se o eletrólito suportará a reação que você deseja estudar ou introduzirá artefatos que invalidarão seus resultados.
A principal conclusão é que um eletrólito não é meramente um condutor passivo. É um componente químico ativo que define os limites operacionais da sua célula eletroquímica e pode participar diretamente de reações secundárias, tornando sua seleção cuidadosa fundamental para a obtenção de dados confiáveis e significativos.

Os Quatro Pilares da Seleção de Eletrólitos
Escolher o eletrólito certo é um processo de equilíbrio de requisitos. O eletrólito ideal facilita a reação desejada, permanecendo completamente inerte e invisível à medição. Podemos dividir esse processo de seleção em quatro considerações críticas.
Pilar 1: Condutividade Iônica
A principal função de um eletrólito é transportar carga entre os eletrodos. Alta condutividade iônica é essencial para isso.
Uma condutividade baixa leva a uma grande queda ôhmica (ou queda de IR), que é uma perda de voltagem através do eletrólito. Isso significa que o potencial que você aplica à sua célula não é o potencial realmente experimentado na superfície do eletrodo, levando a medições imprecisas dos potenciais de reação.
Pense no eletrólito como uma rodovia para íons. Um eletrólito de alta condutividade é uma super-rodovia ampla e desimpedida, enquanto um de baixa condutividade é uma rua lateral congestionada, atrasando tudo e desperdiçando energia.
Pilar 2: Janela de Estabilidade Eletroquímica (ESW)
A janela de estabilidade eletroquímica (ESW) é a faixa de potenciais onde o próprio eletrólito — tanto o sal quanto o solvente — não é oxidado nem reduzido.
Operar fora desta janela é uma falha crítica. Se você aplicar um potencial muito positivo ou muito negativo, começará a decompor o eletrólito em vez de estudar seu analito. Isso cria grandes correntes de fundo que podem obscurecer completamente o sinal que você está tentando medir.
Por exemplo, a ESW da água é de apenas cerca de 1,23 V. Para experimentos que exigem potenciais mais altos, como na pesquisa de baterias de íon-lítio, você deve mudar para solventes orgânicos e sais específicos (por exemplo, LiPF₆ em carbonatos orgânicos) que oferecem uma janela muito mais ampla (~4-5 V).
Pilar 3: Solubilidade e Dissociação
Para que um eletrólito funcione, o sal deve não apenas se dissolver, mas também se dissociar completamente em cátions e ânions de movimento livre no solvente.
Se o sal tiver baixa solubilidade ou formar "pares iônicos" apertados em vez de se separar, o número de portadores de carga disponíveis diminui drasticamente. Isso reduz diretamente a condutividade iônica, comprometendo a função primária do eletrólito.
Sempre garanta que o sal escolhido seja altamente solúvel no solvente selecionado na concentração que você pretende usar (tipicamente 0,1 M a 1,0 M para experimentos em escala de laboratório).
Pilar 4: Compatibilidade Química
O eletrólito deve ser quimicamente inerte em relação a cada componente da sua célula: o eletrodo de trabalho, o contra-eletrodo, o eletrodo de referência e o próprio corpo da célula.
Um erro comum é usar um eletrólito contendo íons cloreto (como KCl) com componentes de aço inoxidável. O cloreto é altamente corrosivo para o aço inoxidável e causará corrosão por pites e liberará íons metálicos em sua solução, contaminando o experimento.
Da mesma forma, os íons do eletrólito não devem reagir ou adsorver muito fortemente na superfície do seu eletrodo, a menos que essa interação seja o fenômeno específico que você está estudando.
Compreendendo as Compensações
Não existe um único eletrólito "melhor"; toda escolha envolve o equilíbrio de fatores concorrentes. Compreender essas compensações é a marca de um pesquisador experiente.
Condutividade vs. Estabilidade
Eletrólitos aquosos (por exemplo, NaCl em água) oferecem excelente condutividade iônica, mas têm uma janela de estabilidade eletroquímica muito estreita. Por outro lado, muitos eletrólitos à base de solventes orgânicos fornecem uma ampla janela de estabilidade, mas frequentemente sofrem de menor condutividade. Sua escolha depende se seu experimento é limitado por voltagem ou eficiência de corrente.
Custo vs. Pureza
Sais e solventes de alta pureza, "grau bateria" ou "grau eletroquímico", são significativamente mais caros. No entanto, impurezas residuais (como água em um eletrólito não aquoso ou íons haletos) podem introduzir sinais eletroquímicos indesejados e arruinar medições sensíveis. Para demonstrações simples, um grau inferior pode ser suficiente, mas para análise quantitativa, investir em pureza é crítico.
O Papel Específico dos Íons
Nem todos os íons são criados iguais. Íons pequenos e móveis como lítio (Li⁺) ou potássio (K⁺) são excelentes portadores de carga. No entanto, grandes íons orgânicos como tetrabutilamônio (TBA⁺) são frequentemente usados para aumentar a solubilidade de analitos apolares em solventes polares e podem ajudar a minimizar interações indesejadas na superfície do eletrodo.
Fazendo a Escolha Certa para o Seu Experimento
Seu objetivo específico dita quais propriedades priorizar.
- Se seu foco principal é a voltametria aquosa padrão: Priorize alta condutividade e use um sal simples e inerte como cloreto de potássio (KCl) ou sulfato de sódio (Na₂SO₄), garantindo que sua faixa de potencial permaneça dentro da janela de estabilidade da água.
- Se seu foco principal é a pesquisa de baterias de alta voltagem: Priorize uma ampla janela de estabilidade eletroquímica e pureza extrema, tipicamente usando sais como LiPF₆ ou LiClO₄ em uma mistura de solventes de carbonato orgânico.
- Se seu foco principal é o estudo de corrosão: Priorize a criação de um eletrólito que imite com precisão o ambiente do mundo real (por exemplo, água salgada), garantindo que ele não corroa seus eletrodos de referência ou contra-eletrodos.
- Se seu foco principal é a espectroeletroquímica: Priorize a transparência óptica tanto do sal quanto do solvente na faixa de comprimento de onda desejada, além dos requisitos eletroquímicos padrão.
Em última análise, o eletrólito que você escolhe prepara o cenário e define as regras para toda a sua medição eletroquímica.
Tabela Resumo:
| Pilar de Seleção | Consideração Chave | Impacto no Experimento |
|---|---|---|
| Condutividade Iônica | Alta mobilidade iônica | Minimiza a perda de voltagem (queda de IR) para controle preciso do potencial. |
| Janela de Estabilidade Eletroquímica (ESW) | Faixa de voltagem de estabilidade | Previne a decomposição do eletrólito e o obscurecimento das correntes de fundo. |
| Solubilidade e Dissociação | Dissociação completa do sal em íons | Garante portadores de carga suficientes para uma condutividade eficaz. |
| Compatibilidade Química | Inertness com componentes da célula | Evita corrosão, contaminação e reações secundárias indesejadas. |
Pronto para otimizar seus experimentos eletroquímicos com o equipamento e consumíveis de laboratório certos? O eletrólito correto é apenas uma parte da equação. A KINTEK é especializada no fornecimento de suprimentos e equipamentos de laboratório de alta pureza, adaptados para eletroquímica, pesquisa de baterias, estudos de corrosão e muito mais. Nossos produtos ajudam você a alcançar o controle preciso e os dados confiáveis que seu trabalho exige.
Entre em contato com nossos especialistas hoje para discutir suas necessidades específicas de aplicação e descobrir como a KINTEK pode apoiar o sucesso do seu laboratório.
Guia Visual
Produtos relacionados
- Célula Eletrolítica Eletroquímica Óptica de Dupla Camada Tipo H com Banho de Água
- Célula Eletrolítica Eletroquímica para Avaliação de Revestimentos
- Célula Eletroquímica Eletrolítica de Quartzo para Experimentos Eletroquímicos
- Célula Eletroquímica Eletrolítica de Banho de Água de Dupla Camada
- Célula Eletroquímica de Eletrólise Espectral de Camada Fina
As pessoas também perguntam
- O que é uma célula tipo H? Um Guia para Células Eletroquímicas Divididas para Experimentos Precisos
- Quais características ópticas a célula eletrolítica tipo H possui? Janelas de quartzo de precisão para fotoeletroquímica
- Quais são as especificações padrão de abertura para uma célula eletrolítica de membrana permutável tipo H? Portas Assimétricas para Eletroquímica Precisa
- Como deve ser armazenada a célula eletrolítica tipo H quando não estiver em uso? Guia Especializado de Armazenamento e Manutenção
- Quais são os volumes típicos e as configurações de abertura para uma célula eletrolítica de banho-maria de dupla camada? Otimize sua Configuração Eletroquímica



















