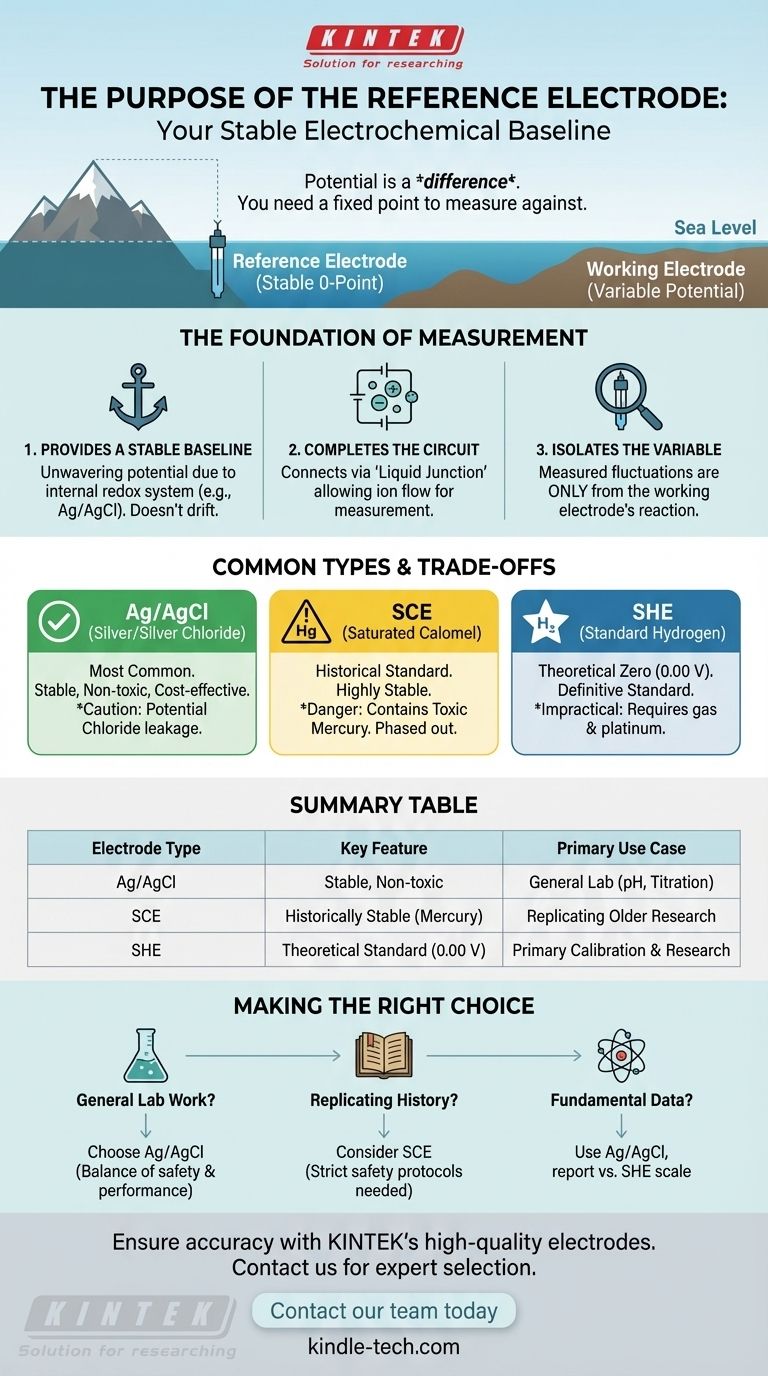
Em qualquer sistema eletroquímico, o propósito de um eletrodo de referência é fornecer um potencial estável, constante e bem conhecido. Ele atua como uma linha de base fixa, ou ponto zero, contra o qual o potencial de um segundo eletrodo — o eletrodo de trabalho — pode ser medido. Ao completar o circuito elétrico, ele torna possível uma medição significativa.
Você não pode medir o potencial de um único eletrodo isoladamente; o potencial é sempre uma diferença entre dois pontos. O eletrodo de referência fornece uma metade confiável e inalterável do sistema, garantindo que qualquer mudança que você meça seja devida exclusivamente à reação química que você está estudando no eletrodo de trabalho.

A Base da Medição Eletroquímica
Para entender o eletrodo de referência, você deve primeiro entender que toda medição eletroquímica requer dois eletrodos para formar uma célula completa. O eletrodo de referência é um desses componentes essenciais.
Fornecendo uma Linha de Base Estável
O potencial é um valor relativo, muito parecido com a altura de uma montanha medida em relação ao nível do mar. O eletrodo de referência atua como o "nível do mar" inabalável para sua medição.
Sua química interna é cuidadosamente projetada usando um sistema redox (como prata e cloreto de prata) com soluções saturadas ou tamponadas. Isso garante que seu próprio potencial não se desvie ou mude durante o experimento.
Completando o Circuito Elétrico
Uma linha de base teórica é inútil sem uma conexão física. O eletrodo de referência faz contato com a solução da amostra através de um componente chamado junção líquida.
Esta junção permite que os íons fluam, completando o circuito elétrico entre os eletrodos de referência e de trabalho. Sem essa conexão, nenhuma medição poderia ser feita.
Isolando a Variável de Interesse
Ao fornecer um potencial constante, o eletrodo de referência permite que o potencial total medido da célula reflita apenas o que está acontecendo no eletrodo de trabalho.
Qualquer flutuação detectada é, portanto, diretamente atribuível à concentração do analito ou à reação que está sendo estudada, que é o objetivo principal da medição.
Tipos Comuns e Suas Vantagens e Desvantagens
Embora todos os eletrodos de referência sirvam ao mesmo propósito, eles não são criados iguais. A escolha do eletrodo envolve vantagens e desvantagens práticas em termos de estabilidade, custo e segurança.
Prata/Cloreto de Prata (Ag/AgCl)
Este é o eletrodo de referência mais amplamente utilizado atualmente. É conhecido por ser relativamente barato, altamente estável e não tóxico.
Sua principal desvantagem é o potencial de vazamento da solução interna da ponte salina (cloreto de potássio) para a amostra, o que pode ser um problema em aplicações sensíveis a íons cloreto.
Eletrodo de Calomelano Saturado (ECS)
O ECS é um eletrodo historicamente significativo, conhecido por sua excepcional estabilidade e confiabilidade. Já foi um padrão de laboratório.
No entanto, ele contém mercúrio, que é altamente tóxico. Devido a preocupações com a segurança e desafios de descarte, seu uso foi amplamente descontinuado em favor do eletrodo Ag/AgCl.
Eletrodo Padrão de Hidrogênio (EPH)
O EPH é a referência teórica definitiva contra a qual todos os outros potenciais de eletrodo são definidos. Seu potencial é definido em exatamente 0,00 volts por convenção.
Apesar de sua importância como padrão, o EPH é extremamente impraticável para uso diário. Ele requer um suprimento constante de gás hidrogênio inflamável e um eletrodo de platina especialmente preparado, tornando-o adequado apenas para calibração primária e pesquisa.
Fazendo a Escolha Certa para o Seu Objetivo
Sua escolha de eletrodo de referência é tipicamente guiada pelos requisitos de sua aplicação em termos de compatibilidade, precisão e segurança.
- Se o seu foco principal é o trabalho geral de laboratório (por exemplo, pH, titulação): O eletrodo de Prata/Cloreto de Prata (Ag/AgCl) é a escolha padrão por seu excelente equilíbrio entre desempenho, segurança e custo.
- Se o seu foco principal é replicar pesquisas mais antigas: Você pode precisar usar um Eletrodo de Calomelano Saturado (ECS) para manter a consistência com dados históricos, mas deve aderir a protocolos de segurança rigorosos.
- Se o seu foco principal é estabelecer dados eletroquímicos fundamentais: Você usará um eletrodo prático como Ag/AgCl, mas relatará seus resultados em relação à escala do Eletrodo Padrão de Hidrogênio (EPH) para comparação universal.
Em última análise, o eletrodo de referência é uma ferramenta simples, mas crítica, que remove a ambiguidade, permitindo que você se concentre na química que importa.
Tabela Resumo:
| Tipo de Eletrodo | Característica Principal | Caso de Uso Primário |
|---|---|---|
| Prata/Cloreto de Prata (Ag/AgCl) | Estável, não tóxico, econômico | Trabalho geral de laboratório (pH, titulação) |
| Calomelano Saturado (ECS) | Historicamente estável, contém mercúrio | Replicação de pesquisas antigas (com protocolos de segurança) |
| Hidrogênio Padrão (EPH) | Padrão teórico (0,00 V) | Calibração primária e pesquisa fundamental |
Garanta a precisão e a confiabilidade de seus experimentos eletroquímicos com o eletrodo de referência certo.
A KINTEK é especializada em equipamentos e consumíveis de laboratório de alta qualidade, incluindo uma gama de eletrodos de referência confiáveis adaptados às necessidades do laboratório. Nossos especialistas podem ajudá-lo a selecionar o eletrodo ideal para sua aplicação específica, garantindo medições precisas e estáveis.
Entre em contato com nossa equipe hoje para discutir suas necessidades e aprimorar as capacidades analíticas do seu laboratório!
Guia Visual
Produtos relacionados
- Eletrodo de Referência de Sulfato de Cobre para Uso em Laboratório
- Eletrodo de Referência Calomelano Cloreto de Prata Sulfato de Mercúrio para Uso Laboratorial
- Eletrodo Eletroquímico de Disco Metálico
- Eletrodo Eletroquímico de Grafite em Disco, Haste e Chapa
- Eletrodo de Disco de Platina Rotativo para Aplicações Eletroquímicas
As pessoas também perguntam
- Quais são as características e aplicações de um eletrodo de folha de grafite? Maximizando a Área de Reação para Eletrólise em Massa
- Qual é a condutividade térmica do grafite em altas temperaturas? Um Guia para o Gerenciamento Térmico em Calor Extremo
- Por que os grânulos de grafite são preferidos como materiais de eletrodo em um sistema de ânodo de leito fixo? Maximizando o Fluxo Microbiano
- Qual é a estrutura básica de um suporte de eletrodo e a função de cada parte? Domine a Chave para Testes Eletroquímicos Confiáveis
- Como se deve manusear um eletrodo de fio de platina? Garanta Medições Precisas e Longevidade
- Qual é a vida útil esperada de um eletrodo de referência de sulfato de cobre? Maximize a Longevidade com a Manutenção Adequada
- Quais são as funções da platina e do SCE em testes de corrosão de revestimentos? Melhore a precisão dos dados em sistemas de 3 eletrodos
- Em que áreas o eletrodo de evolução de oxigênio de irídio-tantálio-titânio é aplicado? Top 6 usos industriais



















