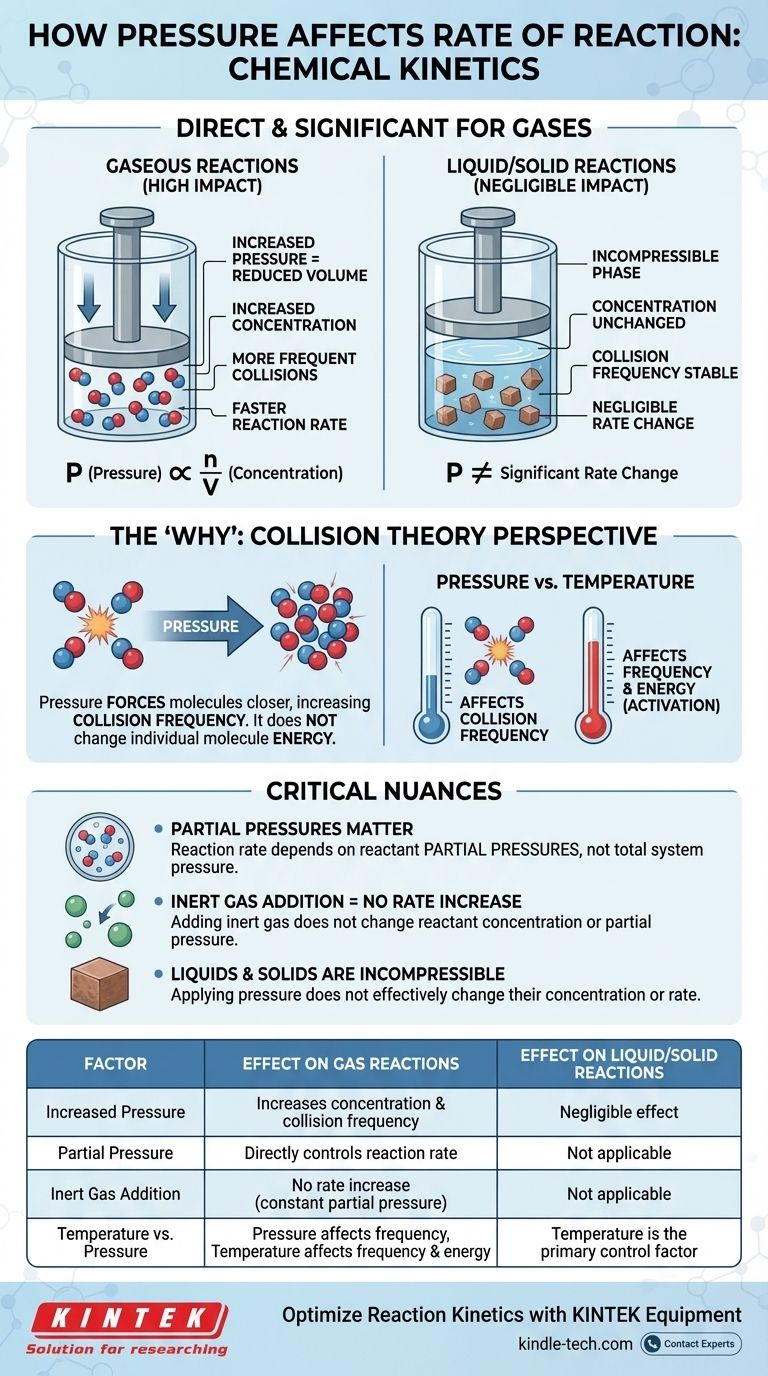
Na cinética química, o efeito da pressão na taxa de reação é direto e significativo, mas apenas para reações que envolvem gases. Para uma reação gasosa, aumentar a pressão eleva a concentração das moléculas reagentes. Isso leva a colisões mais frequentes entre elas, o que, por sua vez, aumenta a taxa geral da reação. Para reações que ocorrem puramente nas fases líquida ou sólida, a pressão tem um efeito insignificante na taxa.
A relação entre pressão e taxa de reação é fundamentalmente uma história sobre concentração. Para gases, aumentar a pressão é simplesmente um meio físico de forçar mais moléculas para o mesmo volume, aumentando a frequência de colisões eficazes e, assim, acelerando a reação.

O Elo Fundamental: Pressão como um Indicador de Concentração
A razão central pela qual a pressão afeta as reações gasosas reside em sua relação direta com a concentração. Este princípio é melhor explicado ao observar as leis fundamentais da química.
O Papel da Lei dos Gases Ideais
A Lei dos Gases Ideais, PV = nRT, fornece o elo matemático. Se a reorganizarmos para resolver a pressão (P = (n/V)RT), podemos ver que a pressão (P) é diretamente proporcional a n/V.
O termo n/V representa os mols (n) por unidade de volume (V), que é a própria definição de concentração molar. Portanto, ao aumentar a pressão de um sistema a uma temperatura constante, você está aumentando diretamente a concentração das moléculas de gás contidas nele.
Como a Concentração Governa a Taxa de Reação
A velocidade de uma reação é definida pela sua lei de velocidade, frequentemente expressa como taxa = k[A]^m[B]^n. Nesta equação, [A] e [B] representam as concentrações dos reagentes.
A lei de velocidade mostra que a taxa de reação depende diretamente da concentração de seus reagentes. Uma concentração maior significa uma taxa mais rápida. Ao conectar isso à lei dos gases, a cadeia de eventos se torna clara: aumentar a pressão aumenta a concentração, o que, por sua vez, aumenta a taxa de reação.
O "Porquê" da Mudança: Uma Perspectiva da Teoria das Colisões
As leis de velocidade nos dizem o que acontece, mas a Teoria das Colisões explica por que isso acontece em nível molecular. Para que ocorra uma reação, as partículas reagentes devem colidir com energia suficiente e com a orientação correta.
O Princípio da Frequência de Colisão
Uma reação química é o resultado de inúmeras colisões moleculares. Quanto mais colisões ocorrerem por segundo, mais oportunidades haverá para que uma reação bem-sucedida ocorra.
Como a Pressão Aumenta as Colisões
Aumentar a pressão sobre um gás reduz o volume que ele ocupa, forçando as moléculas a ficarem mais próximas. Isso aumenta drasticamente sua frequência de colisão — o número de vezes que elas colidem umas com as outras por unidade de tempo.
Embora a pressão não altere a energia das moléculas individuais (esse é o papel da temperatura), ela multiplica o número de eventos de colisão totais. Esse aumento na frequência leva a um aumento proporcional nas colisões bem-sucedidas que causam a reação.
Compreendendo as Nuances e as Compensações
Embora a regra geral se mantenha, um especialista deve entender as condições específicas sob as quais ela se aplica e, mais importante, quando ela não se aplica.
O Papel Crítico das Pressões Parciais
Em uma mistura de gases, a taxa de reação geral depende das pressões parciais dos reagentes específicos, e não da pressão total do sistema. A pressão parcial é a pressão que um único gás exerceria se ocupasse sozinho todo o volume.
Isso significa que você pode aumentar a pressão total adicionando um gás inerte (como argônio ou nitrogênio) ao recipiente de reação. No entanto, como isso não altera a concentração ou a pressão parcial dos reagentes reais, não aumentará a taxa de reação.
O Efeito Insignificante em Líquidos e Sólidos
A pressão tem um impacto insignificante nas taxas de reação em fases condensadas (líquidos e sólidos). Esses estados da matéria já são considerados incompressíveis.
As moléculas em líquidos e sólidos já estão firmemente compactadas. Aplicar pressão externa não diminui significativamente a distância entre elas nem altera sua concentração. Portanto, não é uma alavanca eficaz para alterar suas taxas de reação.
Pressão vs. Temperatura
É crucial distinguir os efeitos da pressão e da temperatura.
- Pressão afeta principalmente a frequência das colisões.
- Temperatura afeta tanto a frequência das colisões (as moléculas se movem mais rápido) quanto, mais importante, a energia de cada colisão.
Aumentar a temperatura aumenta a fração de moléculas que possuem a energia de ativação mínima necessária, tornando-a um fator muito mais poderoso para aumentar as taxas de reação do que a pressão.
Fazendo a Escolha Certa para o Seu Sistema
Compreender este princípio permite que você controle os resultados da reação com base em seus objetivos específicos. Considere o seguinte ao projetar ou otimizar um processo químico.
- Se seu foco principal é maximizar a velocidade de uma reação gasosa: Aumentar a pressão do sistema reduzindo seu volume é um método direto e eficaz para aumentar a vazão.
- Se seu foco principal é controlar uma reação em uma mistura gasosa: Você deve gerenciar as pressões parciais dos reagentes, pois simplesmente adicionar um gás inerte para aumentar a pressão total não acelerará sua reação alvo.
- Se seu foco principal é alterar a taxa de uma reação em um líquido ou sólido: Manipular a pressão não é uma estratégia viável; você deve se concentrar em alterar a temperatura, a concentração de espécies dissolvidas ou usar um catalisador.
Ao entender que a pressão é um indicador da concentração em gases, você ganha controle preciso sobre a cinética do seu sistema.
Tabela de Resumo:
| Fator | Efeito em Reações Gasosas | Efeito em Reações Líquidas/Sólidas |
|---|---|---|
| Aumento da Pressão | Aumenta a concentração e a frequência de colisão | Efeito insignificante (incompressível) |
| Pressão Parcial | Controla diretamente a taxa de reação | Não aplicável |
| Adição de Gás Inerte | Nenhum aumento na taxa (pressão parcial constante) | Não aplicável |
| Temperatura vs. Pressão | A pressão afeta a frequência; a temperatura afeta a frequência e a energia | A temperatura é o principal fator de controle |
Precisa controlar com precisão suas reações químicas? A KINTEK é especializada em equipamentos de laboratório de alta qualidade, incluindo reatores de pressão e sistemas de manuseio de gases, para ajudá-lo a otimizar a cinética de reação e alcançar resultados superiores em seu laboratório. Entre em contato com nossos especialistas hoje mesmo para discutir sua aplicação específica e descobrir a solução certa para suas necessidades.
Guia Visual
Produtos relacionados
- Reatores de Alta Pressão Personalizáveis para Aplicações Científicas e Industriais Avançadas
- Mini Reator Autoclave de Alta Pressão SS para Uso em Laboratório
- Reator Autoclavado de Alta Pressão em Aço Inoxidável Reator de Pressão Laboratorial
- Reator Autoclave de Laboratório de Alta Pressão para Síntese Hidrotermal
- Prensa Isostática a Frio Elétrica de Laboratório CIP para Prensagem Isostática a Frio
As pessoas também perguntam
- O que é uma autoclave de alta pressão? Um Guia Completo para Reatores de Alta Temperatura e Alta Pressão
- Que papel um reator de alta pressão desempenha na síntese de nanotubos de TiO2? Domine a transformação hidrotermal.
- Por que reatores de aço inoxidável de alta pressão são usados para experimentos de hidrogenação seletiva envolvendo catalisadores confinados?
- Como os reatores de temperatura constante de alta precisão garantem a segurança do processo? Garanta um desempenho superior de polímeros
- Por que um manômetro de alta resolução é necessário para a síntese de revestimento de carbono hidrotermal? Garanta Precisão e Segurança
- Quais são as vantagens de usar um autoclave hidrotérmico de alta pressão? Melhore a precisão da síntese do seu catalisador
- Qual é a função dos reatores de alta pressão na preparação de catalisadores semicondutores? Otimize Suas Heterojunções
- Por que uma célula agitada de alta pressão é tipicamente usada para avaliar o desempenho de produção de água de membranas?



















