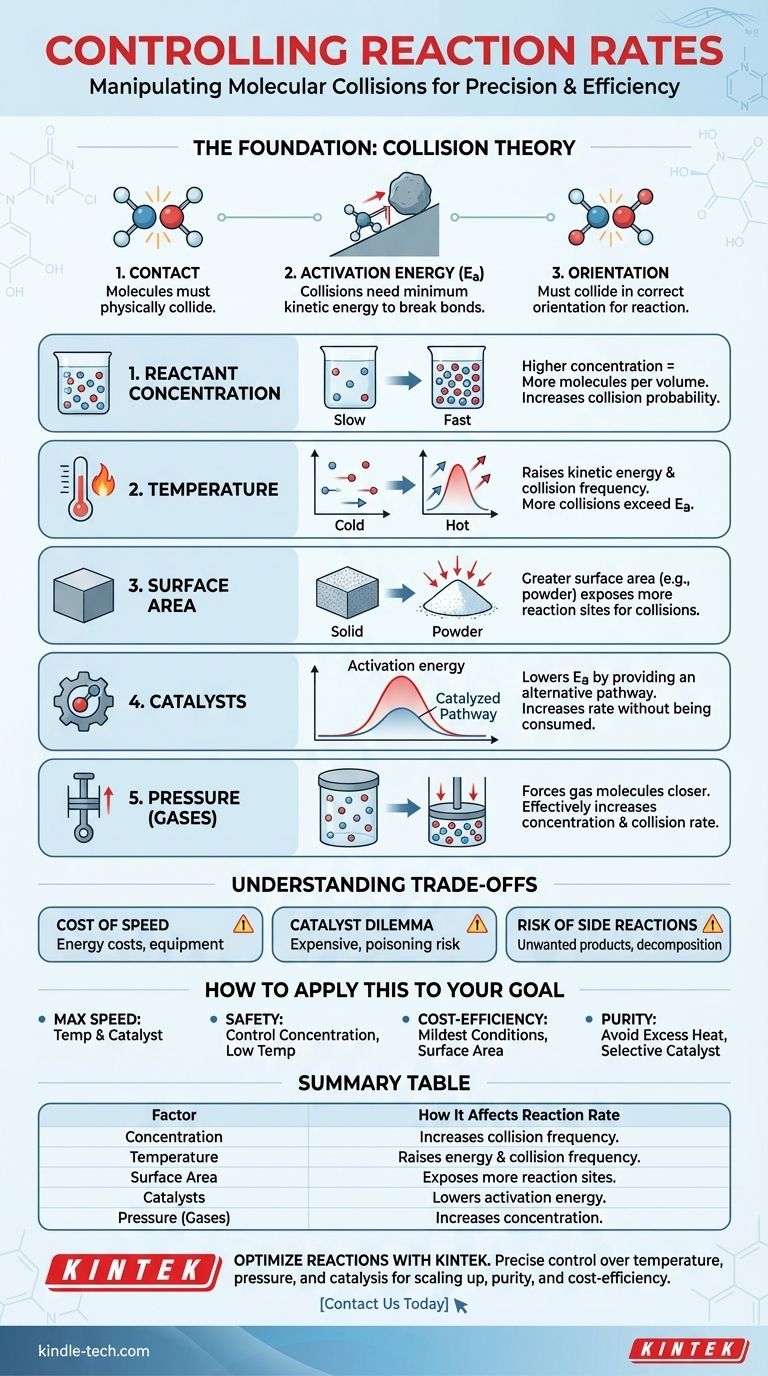
Em essência, cinco fatores principais controlam a taxa de uma reação química: a concentração dos reagentes, a temperatura, o estado físico e a área de superfície dos reagentes, a presença de um catalisador e, para gases, a pressão. Cada um desses fatores influencia a frequência e a energia das colisões moleculares, que é o motor fundamental de toda mudança química.
A velocidade de qualquer reação química é determinada pela frequência com que as moléculas dos reagentes colidem com a orientação correta e com energia suficiente para superar a barreira de energia de ativação da reação. Tudo o que controla as taxas de reação é simplesmente uma alavanca para manipular a frequência e a eficácia dessas colisões.

A Fundação: Teoria das Colisões
Para controlar uma reação, você deve primeiro entender que as reações não são eventos instantâneos. Elas são o resultado de interações físicas entre as moléculas. Isso é explicado pela Teoria das Colisões.
A Necessidade de Contato
Para que uma reação ocorra, as moléculas dos reagentes devem colidir fisicamente umas com as outras. Se estiverem em recipientes separados, nenhuma reação pode acontecer. A taxa da reação está diretamente ligada à taxa dessas colisões.
O Requisito de Energia (Energia de Ativação)
Uma colisão sozinha não é suficiente. As moléculas que colidem devem possuir uma quantidade mínima de energia cinética, conhecida como energia de ativação (Ea). Essa energia é necessária para quebrar as ligações químicas existentes para que novas possam se formar.
Pense na energia de ativação como uma colina sobre a qual você deve empurrar uma pedra. Um leve empurrão (uma colisão de baixa energia) não fará nada. Você precisa fornecer energia suficiente (energia suficiente) para levá-la ao topo da colina, após o que ela pode rolar para o outro lado e liberar energia.
O Fator Orientação
Finalmente, as moléculas devem colidir em uma orientação específica que permita que as ligações corretas se quebrem e novas se formem. Uma colisão aleatória no ângulo errado, mesmo que seja energética o suficiente, não resultará em uma reação.
As Cinco Alavancas para Controlar a Taxa de Reação
Entender a teoria das colisões lhe dá cinco alavancas distintas para puxar para acelerar ou retardar uma reação. Cada uma funciona influenciando a frequência de colisão, a energia de colisão ou a própria barreira de energia de ativação.
1. Concentração dos Reagentes
Aumentar a concentração dos reagentes significa que há mais moléculas compactadas em um determinado volume. Isso aumenta diretamente a probabilidade de elas colidirem, aumentando assim a taxa de reação.
2. Temperatura
Aumentar a temperatura tem um efeito poderoso e duplo. Primeiro, aumenta a energia cinética das moléculas, fazendo-as mover-se mais rapidamente e colidir com mais frequência. Segundo, e mais importante, aumenta a energia dessas colisões, o que significa que uma porcentagem maior delas terá energia suficiente para superar a barreira de energia de ativação.
3. Estado Físico e Área de Superfície
Isso é mais relevante para reações que envolvem diferentes fases, como um sólido reagindo com um líquido (reações heterogêneas). Um bloco sólido tem uma área de superfície limitada onde as colisões podem ocorrer. Moer esse mesmo bloco em um pó fino aumenta drasticamente sua área de superfície, expondo mais moléculas e criando muito mais locais para as reações acontecerem.
4. Catalisadores
Um catalisador aumenta a taxa de reação sem ser consumido no processo. Ele faz isso fornecendo um caminho de reação alternativo com uma energia de ativação mais baixa.
Voltando à nossa analogia, um catalisador é como construir um túnel através da colina. Você não precisa mais empurrar a pedra até o topo; você pode fazê-la chegar ao outro lado com muito menos esforço. Isso permite que mais moléculas reajam com sucesso, mesmo em temperaturas mais baixas.
5. Pressão (para Reações Gasosas)
Para reações envolvendo gases, aumentar a pressão força as moléculas de gás a ficarem mais próximas. Isso é efetivamente o mesmo que aumentar sua concentração, levando a colisões mais frequentes e uma taxa de reação mais rápida.
Entendendo as Compensações
A manipulação das taxas de reação não ocorre sem consequências. Um consultor técnico eficaz deve considerar as implicações práticas e econômicas de cada escolha.
O Custo da Velocidade
Aumentar a temperatura e a pressão requer energia, o que custa dinheiro. Também pode exigir reatores especializados de alta pressão que são caros de construir e manter, introduzindo considerações de segurança.
O Dilema do Catalisador
Os catalisadores podem ser altamente eficazes, mas são frequentemente caros (por exemplo, usando metais preciosos como platina ou paládio). Eles também podem ser muito específicos para uma reação e podem ser desativados por impurezas, um processo conhecido como "envenenamento do catalisador".
Risco de Reações Colaterais Indesejadas
Forçar demais uma reação, especialmente com calor excessivo, pode levar a resultados indesejáveis. Reagentes ou produtos podem começar a se decompor, ou a energia aumentada pode permitir reações colaterais indesejadas, reduzindo a pureza e o rendimento do seu produto desejado.
Como Aplicar Isso ao Seu Objetivo
Sua estratégia para controlar uma reação depende inteiramente do que você está tentando alcançar.
- Se o seu foco principal for velocidade máxima: As alavancas mais poderosas são aumentar a temperatura e usar um catalisador eficaz, pois ambos aumentam drasticamente o número de colisões bem-sucedidas e energéticas.
- Se o seu foco principal for segurança e controle: Gerenciar cuidadosamente a concentração dos reagentes (por exemplo, adicionando um reagente lentamente ao outro) e usar a temperatura efetiva mais baixa são as melhores abordagens.
- Se o seu foco principal for eficiência de custo: Otimize para as condições mais amenas possíveis. Isso pode envolver encontrar um catalisador acessível ou aumentar a área de superfície para evitar os altos custos de energia do calor e pressão extremos.
- Se o seu foco principal for pureza do produto: Evite temperaturas excessivamente altas que possam causar decomposição ou reações colaterais e garanta que seu catalisador seja altamente seletivo para a reação desejada.
Em última análise, controlar uma reação química é a arte de gerenciar com precisão as condições que governam as colisões moleculares.
Tabela de Resumo:
| Fator | Como Afeta a Taxa de Reação |
|---|---|
| Concentração | Maior concentração aumenta a frequência de colisão entre as moléculas dos reagentes. |
| Temperatura | Aumenta a energia molecular e a frequência de colisão; mais colisões excedem a energia de ativação. |
| Área de Superfície | Maior área de superfície (por exemplo, sólido em pó) expõe mais locais de reação para colisões. |
| Catalisadores | Reduz a energia de ativação ao fornecer um caminho de reação alternativo. |
| Pressão (Gases) | Aumenta a concentração de moléculas de gás, levando a colisões mais frequentes. |
Otimize suas reações químicas com equipamentos de precisão da KINTEK. Quer você esteja aumentando a produção, garantindo a pureza do produto ou maximizando a eficiência de custos, nossos equipamentos de laboratório e consumíveis são projetados para lhe dar controle preciso sobre as condições de reação. Deixe que nossos especialistas ajudem você a selecionar as ferramentas certas para gerenciar temperatura, pressão e catálise para suas necessidades específicas. Entre em contato conosco hoje para discutir como podemos apoiar o sucesso do seu laboratório!
Guia Visual
Produtos relacionados
- Mini Reator Autoclave de Alta Pressão SS para Uso em Laboratório
- Reator Autoclavado de Alta Pressão em Aço Inoxidável Reator de Pressão Laboratorial
- Reatores de Alta Pressão Personalizáveis para Aplicações Científicas e Industriais Avançadas
- Máquina de Prensa Hidráulica Automática Calefactada com Placas Calefactadas para Prensa Caliente de Laboratorio 25T 30T 50T
As pessoas também perguntam
- Qual é a pressão em um reator em batelada? Um guia para controle dinâmico e segurança
- Por que é necessário garantir um ambiente livre de oxigênio em um reator de pirólise? Maximizando os rendimentos de bio-óleo e gás de síntese
- Qual o papel dos Arrays de Microreatores de Alto Rendimento na avaliação da cinética de reação da catálise heterogênea?
- Como os reatores de alta pressão são usados para avaliar revestimentos de energia nuclear? Garantir a Segurança DBA e a Conformidade Regulatória
- Como os reatores de explosão a vapor de alta pressão melhoram a eficiência durante o processo de separação da lignina? (Guia de Especialista)
- Como os reatores resistentes a ácidos garantem a pureza da glicerina? Otimize a Acidificação para uma Separação Química Superior
- Qual é a contribuição de um reator hidrotermal para a construção de poros graduados? Modelos de Precisão para TAS
- Quais são as vantagens de usar um reator de alta pressão de laboratório? Aumentar a eficiência da síntese solvotérmica



