Na engenharia química, o aumento da pressão em um reator é fundamentalmente alcançado pela manipulação das variáveis da Lei dos Gases Ideais (PV=nRT). Os métodos mais comuns são introduzir mais material (gás), aumentar a temperatura do sistema ou reduzir mecanicamente o volume do reator. Cada método serve a um propósito distinto e acarreta implicações significativas para a cinética, o equilíbrio e a segurança geral da reação.
O desafio central não é simplesmente como aumentar a pressão, mas por que você está fazendo isso. A escolha do método correto depende inteiramente se o seu objetivo é aumentar a concentração de reagentes, deslocar o equilíbrio químico ou controlar a fase dos materiais dentro do reator.

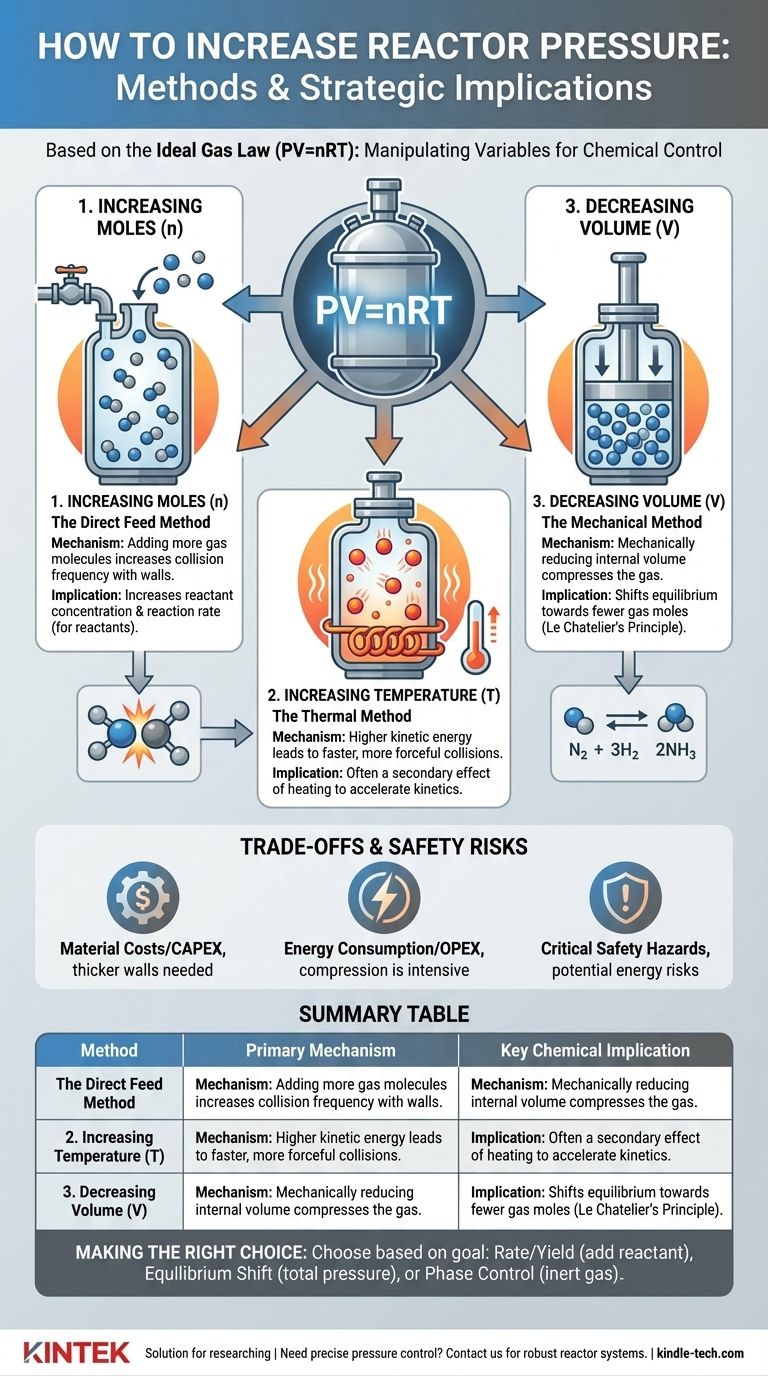
Os Princípios Fundamentais da Geração de Pressão
Em sua essência, a pressão é o resultado das moléculas de gás colidindo com as paredes de um recipiente. Para aumentar essa pressão, você deve tornar essas colisões mais frequentes ou mais vigorosas. A Lei dos Gases Ideais fornece a estrutura teórica para como isso é feito.
Aumentando os Moles (n): O Método de Alimentação Direta
Esta é a abordagem mais direta. Ao adicionar mais moléculas de gás a um volume fixo, você aumenta o número de colisões com as paredes do reator, elevando assim a pressão.
No entanto, existe uma distinção crítica entre adicionar um reagente e adicionar um gás inerte. Adicionar mais de um reagente gasoso aumenta sua pressão parcial, o que aumenta diretamente sua concentração e pode acelerar a taxa de reação.
Inversamente, a adição de um gás inerte (como nitrogênio ou argônio) aumenta a pressão total do sistema, mas não altera as pressões parciais dos reagentes. Esta técnica é frequentemente usada para controlar o comportamento de fase ou para gerenciamento de calor, e não para influenciar diretamente a taxa de reação.
Aumentando a Temperatura (T): O Método Térmico
Aquecer um reator selado aumenta a energia cinética das moléculas de gás no interior. Essas moléculas energizadas movem-se mais rapidamente, levando a colisões mais frequentes e mais vigorosas com as paredes do reator, o que se manifesta como um aumento na pressão.
Este método é frequentemente um efeito secundário de operar uma reação em uma temperatura mais alta para aumentar sua taxa. O aumento da pressão deve ser antecipado e gerenciado como parte do projeto do reator.
Diminuindo o Volume (V): O Método Mecânico
Para certos tipos de reatores, a pressão pode ser aumentada reduzindo mecanicamente o volume interno. Pense em um pistão em um cilindro comprimindo um gás.
Este método é menos comum para reatores contínuos em larga escala, mas é um princípio primário em certos arranjos laboratoriais, processos em batelada e tipos específicos de compressores ou motores.
Implicações Químicas de Pressões Mais Altas
Aumentar a pressão é uma ferramenta poderosa usada para influenciar e controlar o resultado de uma reação química. Não é meramente um parâmetro físico, mas um fator chave do comportamento químico.
Impacto na Taxa de Reação
Para a maioria das reações em fase gasosa, aumentar a pressão adicionando mais reagentes força as moléculas a ficarem mais próximas. Essa concentração mais alta leva a colisões moleculares mais frequentes, o que geralmente resulta em uma taxa de reação mais rápida.
Impacto no Equilíbrio
Isto é regido pelo Princípio de Le Chatelier. Se uma reação reversível tiver um número diferente de moles de gás nos lados dos reagentes e dos produtos, a alteração da pressão deslocará o equilíbrio.
O aumento da pressão favorecerá o lado da reação com menos moles de gás. O exemplo clássico é o processo Haber-Bosch para a síntese de amônia (N₂ + 3H₂ ⇌ 2NH₃), onde alta pressão é usada para deslocar o equilíbrio em direção ao produto, a amônia.
Impacto no Comportamento de Fase
A pressão também é uma ferramenta crítica para controlar o estado físico das substâncias. Alta pressão pode impedir que um líquido ferva, mesmo em altas temperaturas, o que é essencial para muitas reações em fase líquida. Também pode ser usada para liquefazer gases para separação ou para facilitar reações que ocorrem na interface entre um gás e um líquido.
Compreendendo as Compensações e Riscos de Segurança
Embora pressões mais altas possam oferecer vantagens significativas no processo, elas acarretam custos e perigos substanciais que devem ser gerenciados cuidadosamente.
Custos de Material e Construção
Reatores de alta pressão exigem paredes de aço mais espessas, ligas mais avançadas e vedações e conexões altamente especializadas para garantir a contenção. Isso aumenta drasticamente o investimento de capital inicial (CAPEX) de um projeto.
Consumo de Energia
Comprimir gases para altas pressões é um processo extremamente intensivo em energia. Isso se traduz diretamente em maiores despesas operacionais contínuas (OPEX) e pode ter um impacto significativo na viabilidade econômica de um processo.
Riscos Críticos de Segurança
A consideração mais importante é a segurança. Um sistema de alta pressão armazena uma tremenda quantidade de energia potencial. Uma ruptura ou falha pode levar a uma liberação explosiva e catastrófica.
Todos os sistemas de alta pressão devem ser equipados com múltiplas camadas de segurança, incluindo válvulas de alívio de pressão, discos de ruptura e rigorosos protocolos de inspeção e manutenção para mitigar esses riscos.
Fazendo a Escolha Certa para o Seu Objetivo
O método correto para aumentar a pressão é ditado pelo objetivo específico do seu processo químico.
- Se o seu foco principal é aumentar a taxa de reação e o rendimento: Adicionar diretamente mais reagente gasoso é a estratégia mais eficaz, pois aumenta as pressões parciais que impulsionam a reação.
- Se o seu foco principal é deslocar um equilíbrio químico: Aumentar a pressão total do sistema, seja por compressão ou adição de reagentes, é fundamental para reações em que o lado do produto tem menos moles de gás.
- Se o seu foco principal é manter uma fase líquida acima do seu ponto de ebulição normal: Aumentar a pressão total, muitas vezes com um gás inerte, é a chave para criar as condições de processo necessárias.
Em última análise, controlar a pressão do reator é sobre manipular estrategicamente a termodinâmica e a cinética do sistema para alcançar o resultado desejado de forma segura e eficiente.
Tabela de Resumo:
| Método | Mecanismo Principal | Implicação Química Chave |
|---|---|---|
| Aumento dos Moles (n) | Adição de mais moléculas de gás | Aumenta a concentração do reagente/taxa de reação |
| Aumento da Temperatura (T) | Aumento da energia cinética molecular | Efeito secundário do aquecimento para acelerar reações |
| Diminuição do Volume (V) | Compressão mecânica do gás | Desloca o equilíbrio em direção a menos moles de gás |
Precisa de controle de pressão preciso para seus processos laboratoriais? A KINTEK é especializada em equipamentos e consumíveis de laboratório de alta qualidade, incluindo sistemas de reatores robustos projetados para gerenciamento de pressão seguro e eficiente. Nossas soluções ajudam você a alcançar cinética de reação, rendimento e segurança ideais. Entre em contato com a KINTEK hoje para discutir como podemos apoiar as necessidades específicas do seu laboratório.
Guia Visual
Produtos relacionados
- Reatores de Laboratório Personalizáveis de Alta Temperatura e Alta Pressão para Diversas Aplicações Científicas
- Reatores de Alta Pressão Personalizáveis para Aplicações Científicas e Industriais Avançadas
- Autoclave a Vapor Horizontal de Alta Pressão para Laboratório para Uso em Laboratório
- Reator Autoclave de Laboratório de Alta Pressão para Síntese Hidrotermal
- Autoclave Vertical de Esterilizador a Vapor de Alta Pressão para Departamento de Laboratório
As pessoas também perguntam
- Quais são as características técnicas dos reatores hidrotérmicos revestidos de PTFE (Teflon)? Comparando os métodos de síntese de α-ZrP
- Qual papel um autoclave de aço inoxidável revestido de PTFE desempenha na síntese de nanofolhas precursoras de BiOBr?
- Por que um autoclave de síntese hidrotermal de alta pressão é necessário para nanofios de MnO2? Crescimento Preciso de Catalisadores
- Por que os reatores de tubo de liga de alta resistência são críticos para o HHIP? Garantindo segurança e pureza em ambientes de alta pressão
- Por que os reatores SCWG devem manter uma taxa de aquecimento específica? Proteja seus vasos de alta pressão contra estresse térmico



















