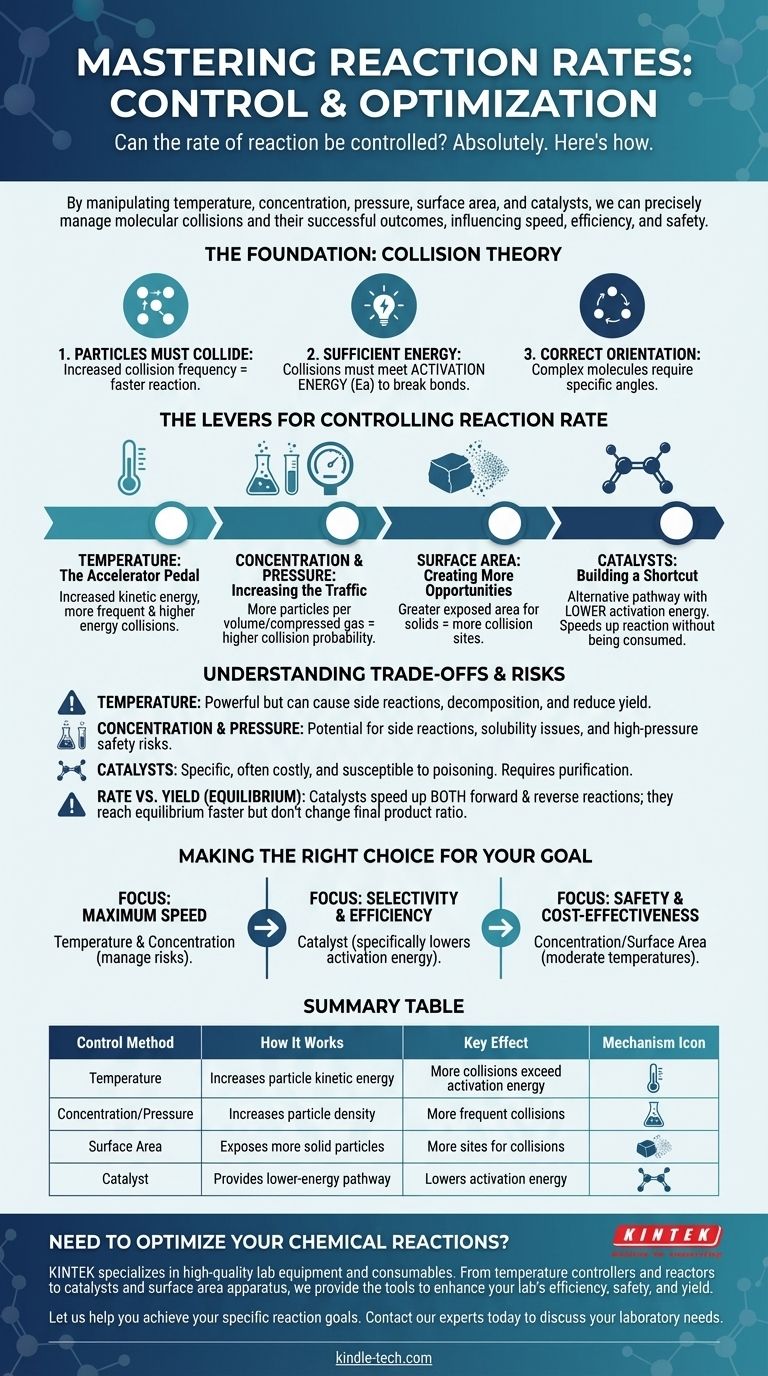
Absolutamente. A taxa de uma reação química não é uma propriedade fixa; ela pode ser controlada com precisão. Ao manipular fatores físicos e químicos específicos, podemos deliberadamente acelerar, retardar ou até mesmo interromper uma reação. As principais alavancas para esse controle são a temperatura, a concentração dos reagentes, a pressão (para gases), a área de superfície (para sólidos) e a introdução de catalisadores.
Controlar a taxa de uma reação é fundamentalmente gerenciar a frequência e a energia das colisões moleculares. Cada método, desde aquecer uma substância até adicionar um catalisador, funciona influenciando com que frequência as partículas colidem e se essas colisões são bem-sucedidas.

A Fundação: Teoria das Colisões
Para controlar uma reação, você deve primeiro entender o que a faz acontecer. A taxa de qualquer reação é governada pelos princípios da teoria das colisões, que afirma que três condições devem ser atendidas para que uma reação ocorra.
1. As Partículas Devem Colidir
Para que duas ou mais moléculas reajam, elas devem primeiro entrar em contato físico. Quanto mais frequentemente as partículas colidem, mais oportunidades elas têm de reagir, o que aumenta a taxa de reação.
2. As Colisões Devem Ter Energia Suficiente
Simplesmente colidir não é suficiente. As partículas que colidem devem possuir uma quantidade mínima de energia cinética combinada, conhecida como energia de ativação (Ea). Essa energia é necessária para quebrar as ligações químicas existentes para que novas possam se formar.
Colisões com energia inferior à energia de ativação serão malsucedidas; as partículas simplesmente ricochetearão umas nas outras inalteradas.
3. As Partículas Devem Ter a Orientação Correta
Para moléculas complexas, a colisão também deve ocorrer em um ângulo ou orientação específicos. Se as partes reativas das moléculas não se alinharem corretamente durante a colisão, nenhuma reação ocorrerá, mesmo que o requisito de energia seja atendido.
As Alavancas para Controlar a Taxa de Reação
Compreender a teoria das colisões nos dá um roteiro claro para manipular a velocidade da reação. Cada método de controle funciona alterando uma ou mais das condições necessárias para uma colisão bem-sucedida.
Temperatura: O Pedal do Acelerador
O aumento da temperatura eleva a energia cinética média das partículas. Isso tem um efeito poderoso e duplo.
Primeiro, faz com que as partículas se movam mais rápido, levando a colisões mais frequentes. Segundo, e mais importante, significa que uma fração muito maior dessas colisões terá energia igual ou superior à energia de ativação, aumentando drasticamente a taxa de reações bem-sucedidas.
Concentração e Pressão: Aumentando o Tráfego
O aumento da concentração de reagentes em uma solução significa que há mais partículas compactadas no mesmo volume. Isso aumenta diretamente a probabilidade de colisão, elevando assim a taxa de reação.
Para gases, o aumento da pressão tem o mesmo efeito. Isso força as moléculas de gás a ficarem mais próximas, aumentando efetivamente sua concentração e levando a colisões mais frequentes.
Área de Superfície: Criando Mais Oportunidades
Este fator é crítico quando um sólido reage com um líquido ou gás. Ao quebrar um sólido em pedaços menores (por exemplo, de um bloco sólido para um pó), você aumenta drasticamente sua área de superfície total.
Isso expõe mais partículas do sólido ao outro reagente, criando muito mais locais onde as colisões podem ocorrer e aumentando a taxa de reação geral.
Catalisadores: Construindo um Atalho
Um catalisador é uma substância que aumenta a taxa de reação sem ser consumida no processo. Ele funciona fornecendo um caminho de reação alternativo com uma energia de ativação mais baixa.
Um catalisador não faz as partículas colidirem com mais frequência ou com mais energia. Em vez disso, ele baixa a "barreira" de energia que uma colisão deve superar para ser bem-sucedida, tornando muito mais fácil para uma reação prosseguir.
Compreendendo as Compensações e Riscos
Embora essas alavancas sejam eficazes, elas não vêm sem consequências. Escolher o método certo requer a compreensão de suas limitações e desvantagens potenciais.
A Força Bruta da Temperatura
O calor é uma ferramenta poderosa, mas indiscriminada. Embora acelere sua reação desejada, também acelerará quaisquer reações colaterais potenciais. Em temperaturas muito altas, pode até fazer com que reagentes ou produtos se decomponham, diminuindo seu rendimento geral.
Os Perigos da Concentração e Pressão
Concentrações elevadas podem, às vezes, levar a reações colaterais indesejadas ou problemas de solubilidade. Mais criticamente, operar em pressões muito altas requer equipamentos especializados, caros e robustos para gerenciar os riscos significativos de uma potencial falha de contenção.
A Especificidade e o Custo dos Catalisadores
Os catalisadores são frequentemente altamente específicos e podem ser muito caros (por exemplo, aqueles que usam platina ou paládio). Eles também podem ser inutilizados por impurezas, um processo conhecido como envenenamento do catalisador, que requer purificação cuidadosa dos reagentes.
Taxa vs. Rendimento (Equilíbrio)
É crucial distinguir entre taxa de reação e rendimento da reação. Para reações reversíveis, que podem ocorrer nas direções direta e reversa, um catalisador acelera ambas as reações igualmente. Isso significa que você atingirá o equilíbrio mais rapidamente, mas não alterará a proporção final de produtos para reagentes.
Fazendo a Escolha Certa para o Seu Objetivo
A estratégia ideal para controlar uma reação depende inteiramente do seu objetivo específico, seja velocidade, eficiência ou segurança.
- Se seu foco principal é velocidade máxima: Aumentar a temperatura e a concentração são suas ferramentas mais diretas, mas você deve gerenciar ativamente os riscos de reações colaterais e perigos de segurança.
- Se seu foco principal é seletividade e eficiência: Um catalisador é frequentemente a melhor escolha, pois pode reduzir especificamente a energia de ativação para sua reação desejada sem promover outras.
- Se seu foco principal é segurança e custo-benefício: Manipular a concentração ou a área de superfície em temperaturas moderadas são frequentemente os métodos mais acessíveis e de menor risco.
Dominar esses fatores permite que você transforme reações químicas de eventos fixos em processos dinâmicos que podem ser direcionados com precisão para alcançar um resultado específico.
Tabela de Resumo:
| Método de Controle | Como Funciona | Efeito Principal |
|---|---|---|
| Temperatura | Aumenta a energia cinética das partículas | Mais colisões excedem a energia de ativação |
| Concentração/Pressão | Aumenta a densidade de partículas | Colisões mais frequentes |
| Área de Superfície | Expõe mais partículas de reagente sólido | Mais locais para colisões |
| Catalisador | Fornece um caminho de reação de menor energia | Reduz a energia de ativação |
Precisa Otimizar Suas Reações Químicas?
O controle preciso das taxas de reação é fundamental para o sucesso do trabalho em laboratório. Se você precisa acelerar uma síntese, melhorar a seletividade ou garantir uma operação segura, o equipamento certo é essencial.
A KINTEK é especializada no fornecimento de equipamentos e consumíveis de laboratório de alta qualidade para ajudá-lo a dominar essas variáveis. Desde controladores de temperatura de precisão e reatores para gerenciar calor e pressão até uma ampla gama de catalisadores e aparelhos projetados para interação ideal da área de superfície, temos as ferramentas para aumentar a eficiência, segurança e rendimento do seu laboratório.
Deixe-nos ajudá-lo a alcançar seus objetivos específicos de reação. Contate nossos especialistas hoje para discutir suas necessidades de laboratório e encontrar a solução perfeita.
Guia Visual
Produtos relacionados
- Reatores de Alta Pressão Personalizáveis para Aplicações Científicas e Industriais Avançadas
- Reatores de Laboratório Personalizáveis de Alta Temperatura e Alta Pressão para Diversas Aplicações Científicas
- Mini Reator Autoclave de Alta Pressão SS para Uso em Laboratório
- Reator Autoclave de Laboratório de Alta Pressão para Síntese Hidrotermal
- Prensa Isostática a Quente WIP Estação de Trabalho 300Mpa para Aplicações de Alta Pressão
As pessoas também perguntam
- Que papéis os autoclaves desempenham na síntese de zeólitos MFI? Domine o Crescimento Cristalino Hidrotérmico
- Qual é o propósito de usar gás argônio de alta pureza em um reator de alta pressão? Garanta dados precisos de teste de corrosão
- Qual é o papel dos reatores de alta pressão no estudo da oxidação de ligas? Ferramentas Essenciais para Pesquisa Supercrítica
- Por que os vasos de reação de laboratório selados são necessários na síntese hidrotermal de zeólitas? Garanta Pureza e Rendimento
- Como um reator de alta pressão demonstra seu valor no envelhecimento acelerado? Preveja a durabilidade do catalisador rapidamente



















